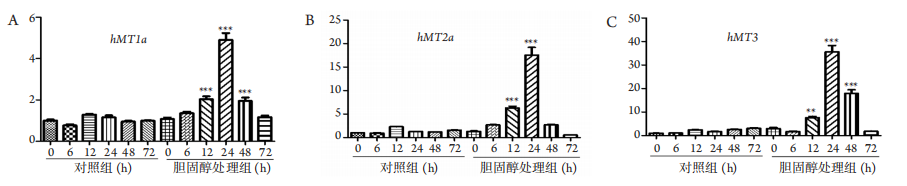
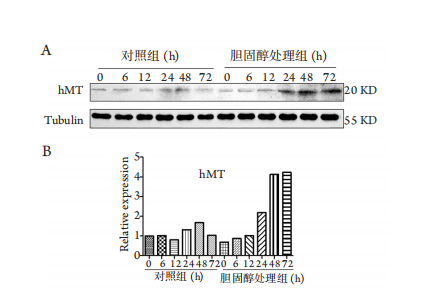
1、宁凤, 傅俊江, 陈汉春. 金属硫蛋白及其生物学功能[ J]. 中国生
物化学与分子生物学报, 2017, 33(9): 46-52.
NING Feng, FU Junjiang, CHEN Hanchun. Metallothionein and
their biological functions[ J]. Chinese Journal of Biochemistry and
Molecular Biology, 2017, 33(9): 46-52.宁凤, 傅俊江, 陈汉春. 金属硫蛋白及其生物学功能[ J]. 中国生
物化学与分子生物学报, 2017, 33(9): 46-52.
NING Feng, FU Junjiang, CHEN Hanchun. Metallothionein and
their biological functions[ J]. Chinese Journal of Biochemistry and
Molecular Biology, 2017, 33(9): 46-52.
2、蒋仕秋, 曾江华, 刘海荣, 等. 金属硫蛋白2A生物功能及其在临
床中的作用研究[ J]. 成都医学院学报, 2019, 14(6): 823-826.
JIANG Shiqiu, CENG Jianghua, LIU Hairong, et al. Study on biological
function of metallothionein 2a and its clinical role[ J]. Journal of
Chengdu Medical College, 2019, 14(6): 823-826.蒋仕秋, 曾江华, 刘海荣, 等. 金属硫蛋白2A生物功能及其在临
床中的作用研究[ J]. 成都医学院学报, 2019, 14(6): 823-826.
JIANG Shiqiu, CENG Jianghua, LIU Hairong, et al. Study on biological
function of metallothionein 2a and its clinical role[ J]. Journal of
Chengdu Medical College, 2019, 14(6): 823-826.
3、Lindeque JZ, Levanets O, Louw R , et al. The involvement of
metallothioneins in mitochondrial function and disease[ J]. Curr
Protein Pept Sci, 2010, 11(4): 292-309.Lindeque JZ, Levanets O, Louw R , et al. The involvement of
metallothioneins in mitochondrial function and disease[ J]. Curr
Protein Pept Sci, 2010, 11(4): 292-309.
4、Nishimura H, Nishimura N, Kobayashi S, et al. Immunohistochemical
localization of metallothionein in the eye of rats[ J]. Histochemistry,
1991, 95(6): 535-539.Nishimura H, Nishimura N, Kobayashi S, et al. Immunohistochemical
localization of metallothionein in the eye of rats[ J]. Histochemistry,
1991, 95(6): 535-539.
5、Sato M, Abe T, Tamai M. Analysis of the metallothionein gene
in age-related macular degeneration[ J]. Jpn J Ophthalmol, 2000,
44(2): 115-121.Sato M, Abe T, Tamai M. Analysis of the metallothionein gene
in age-related macular degeneration[ J]. Jpn J Ophthalmol, 2000,
44(2): 115-121.
6、Ito Y, Tanaka H, Hara H. The potential roles of metallothionein as a
therapeutic target for cerebral ischemia and retinal diseases[ J]. Curr
Pharm Biotechnol, 2013, 14(4): 400-407.Ito Y, Tanaka H, Hara H. The potential roles of metallothionein as a
therapeutic target for cerebral ischemia and retinal diseases[ J]. Curr
Pharm Biotechnol, 2013, 14(4): 400-407.
7、Tate DJ, Miceli MV, Newsome DA. Phagocytosis and H2O2 induce
catalase and metallothionein gene expression in human retinal pigment
epithelial cells[ J]. Invest Ophthalmol Vis Sci, 1995, 36(7): 1271-1279Tate DJ, Miceli MV, Newsome DA. Phagocytosis and H2O2 induce
catalase and metallothionein gene expression in human retinal pigment
epithelial cells[ J]. Invest Ophthalmol Vis Sci, 1995, 36(7): 1271-1279
8、Karlsson M, Kurz T. Attenuation of iron-binding proteins in ARPE-19
cells reduces their resistance to oxidative stress[ J]. Acta Ophthalmol,
2016, 94(6): 556-564.Karlsson M, Kurz T. Attenuation of iron-binding proteins in ARPE-19
cells reduces their resistance to oxidative stress[ J]. Acta Ophthalmol,
2016, 94(6): 556-564.
9、Karlsson M, Frennesson C, Gustafsson T, et al. Autophagy of iron�binding proteins may contribute to the oxidative stress resistance of
ARPE-19 cells[ J]. Exp Eye Res, 2013, 116: 359-365.Karlsson M, Frennesson C, Gustafsson T, et al. Autophagy of iron�binding proteins may contribute to the oxidative stress resistance of
ARPE-19 cells[ J]. Exp Eye Res, 2013, 116: 359-365.
10、Alvarez L, Garcia M, Rodriguez SM, et al. The zinc-metallothionein
redox system in human retina and RPE[ J]. Acta Ophthalmol, 2016,
94: S256.Alvarez L, Garcia M, Rodriguez SM, et al. The zinc-metallothionein
redox system in human retina and RPE[ J]. Acta Ophthalmol, 2016,
94: S256.
11、Gonzalez-Iglesias H, Alvarez L, García M, et al. Metallothioneins (MTs)
in the human eye: a perspective article on the zinc-MT redox cycle[ J].
Metallomics, 2014, 6(2): 201-208Gonzalez-Iglesias H, Alvarez L, García M, et al. Metallothioneins (MTs)
in the human eye: a perspective article on the zinc-MT redox cycle[ J].
Metallomics, 2014, 6(2): 201-208
12、Lu H, Hunt DM, Ganti R, et al. Metallothionein protects retinal
pigment epithelial cells against apoptosis and oxidative stress[ J]. Exp
Eye Res, 2002, 74(1): 83-92.Lu H, Hunt DM, Ganti R, et al. Metallothionein protects retinal
pigment epithelial cells against apoptosis and oxidative stress[ J]. Exp
Eye Res, 2002, 74(1): 83-92.
13、Tsuruma K, Shimazaki H, Ohno Y, et al. Metallothionein-III deficiency
exacerbates light-induced retinal degeneration[ J]. Invest Ophthalmol
Vis Sci, 2012, 53(12): 7896-7903.Tsuruma K, Shimazaki H, Ohno Y, et al. Metallothionein-III deficiency
exacerbates light-induced retinal degeneration[ J]. Invest Ophthalmol
Vis Sci, 2012, 53(12): 7896-7903.
14、Chen L, Wu W, Dentchev T, et al. Increased metallothionein in light
damaged mouse retinas[ J]. Exp Eye Res, 2004, 79(2): 287-293.Chen L, Wu W, Dentchev T, et al. Increased metallothionein in light
damaged mouse retinas[ J]. Exp Eye Res, 2004, 79(2): 287-293.
15、Suemori S, Shimazawa M, Kawase K, et al. Metallothionein, an
endogenous antioxidant, protects against retinal neuron damage in
mice[ J]. Invest Ophthalmol Vis Sci, 2006, 47(9): 3975-3982.Suemori S, Shimazawa M, Kawase K, et al. Metallothionein, an
endogenous antioxidant, protects against retinal neuron damage in
mice[ J]. Invest Ophthalmol Vis Sci, 2006, 47(9): 3975-3982.
16、Zaj?c-Pytrus HM, Pilecka A, Turno-Kr?cicka A, et al. The dry form
of age-related macular degeneration (AMD): the current concepts of
pathogenesis and prospects for treatment[ J]. Adv Clin Exp Med, 2015,
24(6): 1099-1104.Zaj?c-Pytrus HM, Pilecka A, Turno-Kr?cicka A, et al. The dry form
of age-related macular degeneration (AMD): the current concepts of
pathogenesis and prospects for treatment[ J]. Adv Clin Exp Med, 2015,
24(6): 1099-1104.
17、Thompson RB, Reffatto V, Bundy JG, et al. Identification of
hydroxyapatite spherules provides new insight into subretinal pigment
epithelial deposit formation in the aging eye[ J]. Proc Natl Acad Sci U S
A, 2015, 112(5): 1565-1570.Thompson RB, Reffatto V, Bundy JG, et al. Identification of
hydroxyapatite spherules provides new insight into subretinal pigment
epithelial deposit formation in the aging eye[ J]. Proc Natl Acad Sci U S
A, 2015, 112(5): 1565-1570.
18、Usui H, Nishiwaki A, Landiev L, et al. In vitro drusen model-three�dimensional spheroid culture of retinal pigment epithelial cells[ J]. J
Cell Sci, 2019, 132(4): jcs215798.Usui H, Nishiwaki A, Landiev L, et al. In vitro drusen model-three�dimensional spheroid culture of retinal pigment epithelial cells[ J]. J
Cell Sci, 2019, 132(4): jcs215798.
19、Pilgrim MG, Lengyel I, Lanzirotti A, et al. Subretinal pigment epithelial
deposition of drusen components including hydroxyapatite in a
primary cell culture model[ J]. Invest Ophthalmol Vis Sci, 2017, 58(2):
708-719.Pilgrim MG, Lengyel I, Lanzirotti A, et al. Subretinal pigment epithelial
deposition of drusen components including hydroxyapatite in a
primary cell culture model[ J]. Invest Ophthalmol Vis Sci, 2017, 58(2):
708-719.
20、Choi JA, Hwang JU, Yoon YH, et al. Methallothionein-3 contributes
to vascular endothelial growth factor induction in a mouse model of
choroidal neovascularization[ J]. Metallomics, 2013, 5(10): 1387-1396.Choi JA, Hwang JU, Yoon YH, et al. Methallothionein-3 contributes
to vascular endothelial growth factor induction in a mouse model of
choroidal neovascularization[ J]. Metallomics, 2013, 5(10): 1387-1396.