
|
不符合(0) |
基本符合(1) |
完全符合(2) |
不适用(NA) |
|
|
一、项目启动前的规范性评价 |
|
|
|
|
|
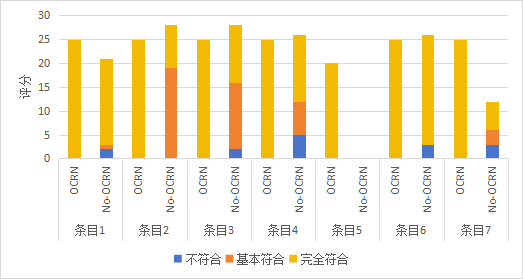
1. 临床研究通过机构科学性审查 |
|
|
|
|
|
2. 按要求保存伦理审查批件、年度/跟踪审查及意见函 |
|
|
|
|
|
3. 临床研究的有关信息按要求在首例参与者签署知情同意书前在国家医学研究登记备案信息系统完成上传并获得备案号 |
|
|
|
|
|
4. 干预性临床研究按相关要求在首例参与者签署知情同意书前在相应平台完成注册 |
|
|
|
|
|
5. 临床研究涉及人遗办审批或备案情况 需要在开展相关研究前完成 |
|
|
|
|
|
6. 临床研究经机构批准立项 |
|
|
|
|
|
7. 机构开展临床研究或参与多中心临床研究的 与立项部门或资助方签署任务书或合作协议 明确双方权利、义务及责任分担等 |
|
|
|
|
|
二、过程文件的规范性评价 |
|
|
|
|
|
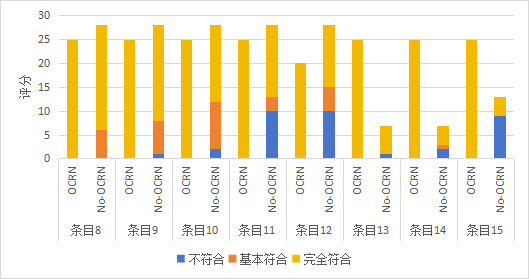
8. 按要求保存伦理批准的方案 |
|
|
|
|
|
9. 按要求保存伦理批准的知情同意书 |
|
|
|
|
|
10. 主要研究者及团队开展临床研究取得法律法规要求的资质 具备相应能力 |
|
|
|
|
|
11. 按要求保存培训和启动记录 |
|
|
|
|
|
12. 按要求保存研究者分工授权表 |
|
|
|
|
|
13. 按要求保存临床研究投保单 |
|
|
|
|
|
14. 按要求保存方案变更、暂停、终止、结题的报告 |
|
|
|
|
|
15. 按要求保存方案违背报告 |
|
|
|
|
|
三、随访过程实施规范性评价 |
|
|
|
|
|
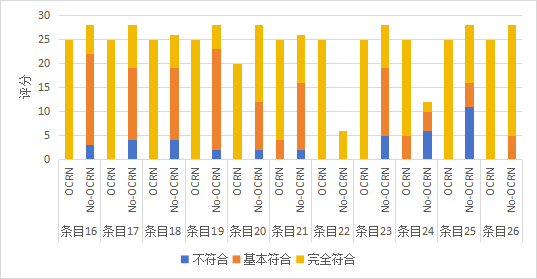
16. 所有参与者按要求签署知情同意书 |
|
|
|
|
|
17. 入组参与者符合入组标准 不符合排除标准 |
|
|
|
|
|
18. 按要求实施盲法和随机 |
|
|
|
|
|
19. 按要求保存参与者筛选/入组/随访的原始记录 |
|
|
|
|
|
20. 按方案要求实施临床研究 保护参与者安全和利益 |
|
|
|
|
|
21. CRF按要求填写 |
|
|
|
|
|
22. 按要求给予参与者补偿 |
|
|
|
|
|
23. 临床研究数据可查询、可溯源 |
|
|
|
|
|
24. 按要求处理、记录和报告不良事件及严重不良事件 |
|
|
|
|
|
25. 主要研究者定期开展自查 |
|
|
|
|
|
26. 保护参与者隐私 |
|
|
|
|
附图1 临床研究项目质量评分频数分布(OCRN:有OCRN参与;No-OCRN:无OCRN参与)
Figure 1 Frequency distribution of quality scores for clinical research projects (CRN: with Clinical Research Nurse involvement; No-CRN: without Clinical Research Nurse involvement)


点击右上角菜单,浏览器打开下载