1、Katayama A, Patel P, Pianelli A, et al. Abdominal organ transplantation: noteworthy literature in 2024[J]. Semin Cardiothorac Vasc Anesth, 2025, 29(2): 147-158. DOI:10.1177/10892532251328204. Katayama A, Patel P, Pianelli A, et al. Abdominal organ transplantation: noteworthy literature in 2024[J]. Semin Cardiothorac Vasc Anesth, 2025, 29(2): 147-158. DOI:10.1177/10892532251328204.
2、Chen B, Zhang H, Zhai Q, et al. Traumatic optic neuropathy: a review of current studies[J]. Neurosurg Rev, 2022, 45(3): 1895-1913. DOI:10.1007/s10143-021-01717-9. Chen B, Zhang H, Zhai Q, et al. Traumatic optic neuropathy: a review of current studies[J]. Neurosurg Rev, 2022, 45(3): 1895-1913. DOI:10.1007/s10143-021-01717-9.
3、Gu L, Poddar S, Lin Y, et al. A biomimetic eye with a hemispherical perovskite nanowire array retina[J]. Nature, 2020, 581(7808): 278-282. DOI:10.1038/s41586-020-2285-x. Gu L, Poddar S, Lin Y, et al. A biomimetic eye with a hemispherical perovskite nanowire array retina[J]. Nature, 2020, 581(7808): 278-282. DOI:10.1038/s41586-020-2285-x.
4、Lu Y, Brommer B, Tian X, et al. Reprogramming to recover youthful epigenetic information and restore vision[J]. Nature, 2020, 588(7836): 124-129. DOI:10.1038/s41586-020-2975-4. Lu Y, Brommer B, Tian X, et al. Reprogramming to recover youthful epigenetic information and restore vision[J]. Nature, 2020, 588(7836): 124-129. DOI:10.1038/s41586-020-2975-4.
5、Lee J, Nguyen S, Bhattacharya S. Optic nerve regeneration: Potential treatment approaches[J]. Curr Opin Pharmacol, 2024, 74: 102428. DOI:10.1016/j.coph.2023.102428. Lee J, Nguyen S, Bhattacharya S. Optic nerve regeneration: Potential treatment approaches[J]. Curr Opin Pharmacol, 2024, 74: 102428. DOI:10.1016/j.coph.2023.102428.
6、Bekono-Nessah%20I%2C%20Duah-Asante%20KA%2C%20Poku%20D%2C%20et%20al.%20Whole-eye%20transplantation%3A%20how%20far%20are%20we%20from%20a%20breakthrough%3F%5BJ%5D.%20Ophthalmic%20Plast%20Reconstr%20Surg%2C%202024%2C%2040(6)%3A%20597-602.%20DOI%3A10.1097%2FIOP.0000000000002738.%20Bekono-Nessah%20I%2C%20Duah-Asante%20KA%2C%20Poku%20D%2C%20et%20al.%20Whole-eye%20transplantation%3A%20how%20far%20are%20we%20from%20a%20breakthrough%3F%5BJ%5D.%20Ophthalmic%20Plast%20Reconstr%20Surg%2C%202024%2C%2040(6)%3A%20597-602.%20DOI%3A10.1097%2FIOP.0000000000002738.%20
7、Bourne D, Li Y, Komatsu C, et al. Whole-eye transplantation: a look into the past and vision for the future[J]. Eye, 2017, 31(2): 179-184. DOI:10.1038/eye.2016.272. Bourne D, Li Y, Komatsu C, et al. Whole-eye transplantation: a look into the past and vision for the future[J]. Eye, 2017, 31(2): 179-184. DOI:10.1038/eye.2016.272.
8、Gokoffski KK, Washington KM, Chuck RS. Clinical and scientific considerations for whole eye transplantation: an ophthalmologist’s perspective[J]. Transl Vis Sci Technol, 2025, 14(2): 13. DOI:10.1167/tvst.14.2.13. Gokoffski KK, Washington KM, Chuck RS. Clinical and scientific considerations for whole eye transplantation: an ophthalmologist’s perspective[J]. Transl Vis Sci Technol, 2025, 14(2): 13. DOI:10.1167/tvst.14.2.13.
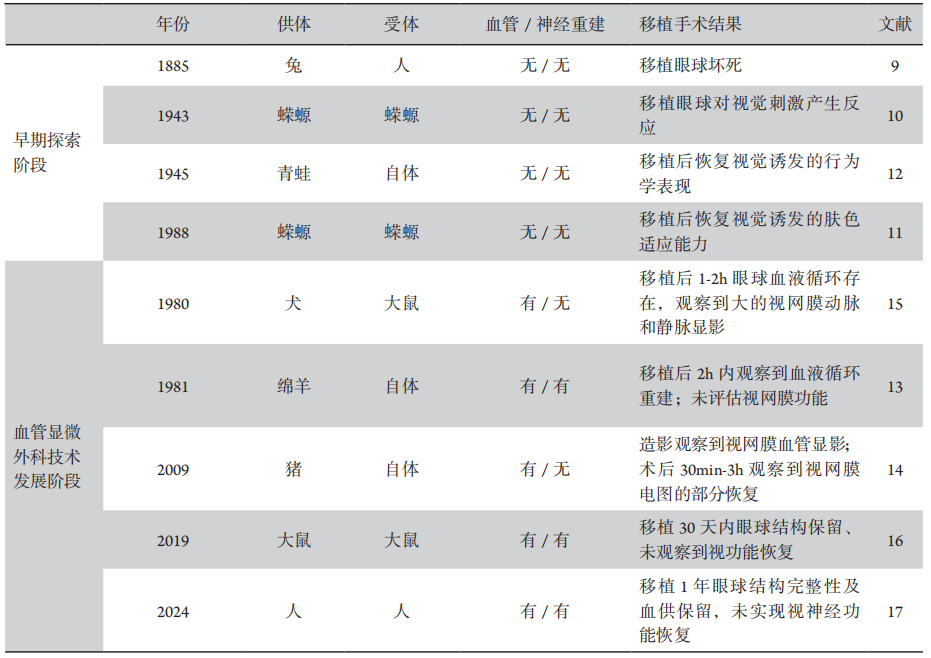
9、The latest surgical triumph - the transplantation of eye from rabbit to man[J]. Daniels Tex Med J, 1885, 1(1): 27. The latest surgical triumph - the transplantation of eye from rabbit to man[J]. Daniels Tex Med J, 1885, 1(1): 27.
10、Stone LS, Cole CH. Grafted eyes of young and old adult salamanders (amblystoma punctatum) showing return of vision[J]. Yale J Biol Med, 1943, 15(5): 735-754.2. Stone LS, Cole CH. Grafted eyes of young and old adult salamanders (amblystoma punctatum) showing return of vision[J]. Yale J Biol Med, 1943, 15(5): 735-754.2.
11、Pietsch P, Schneider CW. Transplanted eyes of foreign donors can reinstate the optically activated skin camouflage reactions in bilaterally enucleated salamanders (Ambystoma)[J]. Brain Behav Evol, 1988, 32(6): 364-370. DOI:10.1159/000116563. Pietsch P, Schneider CW. Transplanted eyes of foreign donors can reinstate the optically activated skin camouflage reactions in bilaterally enucleated salamanders (Ambystoma)[J]. Brain Behav Evol, 1988, 32(6): 364-370. DOI:10.1159/000116563.
12、Sperry RW. Restoration of vision after crossing of optic nerves and after contralateral transplantation of eye[J]. J Neurophysiol, 1945, 8(1): 15-28. DOI:10.1152/jn.1945.8.1.15. Sperry RW. Restoration of vision after crossing of optic nerves and after contralateral transplantation of eye[J]. J Neurophysiol, 1945, 8(1): 15-28. DOI:10.1152/jn.1945.8.1.15.
13、Sher H. Revascularization of autotransplanted ovine eyes by microsurgical anastomosis[J]. J Microsurg, 1981, 2(4): 269-272. DOI:10.1002/micr.1920020408. Sher H. Revascularization of autotransplanted ovine eyes by microsurgical anastomosis[J]. J Microsurg, 1981, 2(4): 269-272. DOI:10.1002/micr.1920020408.
14、Shi J, Ellenberg D, Kim JY, et al. Restoration of electroretinogram activity in exenterated swine eyes following ophthalmic artery anastomosis[J]. Restor Neurol Neurosci, 2009, 27(4): 351-357. DOI:10.3233/RNN-2009-0485. Shi J, Ellenberg D, Kim JY, et al. Restoration of electroretinogram activity in exenterated swine eyes following ophthalmic artery anastomosis[J]. Restor Neurol Neurosci, 2009, 27(4): 351-357. DOI:10.3233/RNN-2009-0485.
15、Sher H, Cohen RJ. Revascularization of isolated extracorporeal canine eyes by direct microsurgical anastomosis[J]. J Microsurg, 1980, 1(5): 399-402. DOI:10.1002/micr.1920010512. Sher H, Cohen RJ. Revascularization of isolated extracorporeal canine eyes by direct microsurgical anastomosis[J]. J Microsurg, 1980, 1(5): 399-402. DOI:10.1002/micr.1920010512.
16、Zor F, Polat M, Kulahci Y, et al. Demonstration of technical feasibility and viability of whole eye transplantation in a rodent model[J]. J Plast Reconstr Aesthet Surg, 2019, 72(10): 1640-1650. DOI:10.1016/j.bjps.2019.05.042. Zor F, Polat M, Kulahci Y, et al. Demonstration of technical feasibility and viability of whole eye transplantation in a rodent model[J]. J Plast Reconstr Aesthet Surg, 2019, 72(10): 1640-1650. DOI:10.1016/j.bjps.2019.05.042.
17、Ceradini DJ, Tran DL, Dedania VS, et al. Combined whole eye and face transplant: microsurgical strategy and 1-year clinical course[J]. JAMA, 2024, 332(18): 1551-1558. DOI:10.1001/jama.2024.12601. Ceradini DJ, Tran DL, Dedania VS, et al. Combined whole eye and face transplant: microsurgical strategy and 1-year clinical course[J]. JAMA, 2024, 332(18): 1551-1558. DOI:10.1001/jama.2024.12601.
18、Hayreh SS. Acute retinal arterial occlusive disorders[J]. Prog Retin Eye Res, 2011, 30(5): 359-394. DOI:10.1016/j.preteyeres.2011.05.001. Hayreh SS. Acute retinal arterial occlusive disorders[J]. Prog Retin Eye Res, 2011, 30(5): 359-394. DOI:10.1016/j.preteyeres.2011.05.001.
19、L%C3%B3pez-Mart%C3%ADnez%20S%2C%20Sim%C3%B3n%20C%2C%20Santamaria%20X.%20Normothermic%20machine%20perfusion%20systems%3A%20where%20do%20we%20go%20from%20here%3F%5BJ%5D.%20Transplantation%2C%202024%2C%20108(1)%3A%2022-44.%20DOI%3A10.1097%2FTP.0000000000004573.%20L%C3%B3pez-Mart%C3%ADnez%20S%2C%20Sim%C3%B3n%20C%2C%20Santamaria%20X.%20Normothermic%20machine%20perfusion%20systems%3A%20where%20do%20we%20go%20from%20here%3F%5BJ%5D.%20Transplantation%2C%202024%2C%20108(1)%3A%2022-44.%20DOI%3A10.1097%2FTP.0000000000004573.%20
20、Chen C, Singh G, Madike R, et al. Central retinal artery occlusion: a stroke of the eye[J]. Eye, 2024, 38(12): 2319-2326. DOI:10.1038/s41433-024-03029-w. Chen C, Singh G, Madike R, et al. Central retinal artery occlusion: a stroke of the eye[J]. Eye, 2024, 38(12): 2319-2326. DOI:10.1038/s41433-024-03029-w.
21、Sousa Da Silva RX, Weber A, Dutkowski P, et al. Machine perfusion in liver transplantation[J]. Hepatology, 2022, 76(5): 1531-1549. DOI:10.1002/hep.32546. Sousa Da Silva RX, Weber A, Dutkowski P, et al. Machine perfusion in liver transplantation[J]. Hepatology, 2022, 76(5): 1531-1549. DOI:10.1002/hep.32546.
22、Ellenberg D, Shi J, Jain S, et al. Impediments to eye transplantation: ocular viability following optic-nerve transection or enucleation[J]. Br J Ophthalmol, 2009, 93(9): 1134-1140. DOI:10.1136/bjo.2008.155267. Ellenberg D, Shi J, Jain S, et al. Impediments to eye transplantation: ocular viability following optic-nerve transection or enucleation[J]. Br J Ophthalmol, 2009, 93(9): 1134-1140. DOI:10.1136/bjo.2008.155267.
23、Ellenberg D, Shi J, Jain S, et al. Impediments to eye transplantation: ocular viability following optic-nerve transection or enucleation[J]. Br J Ophthalmol, 2009, 93(9): 1134-1140. DOI:10.1136/bjo.2008.155267. Ellenberg D, Shi J, Jain S, et al. Impediments to eye transplantation: ocular viability following optic-nerve transection or enucleation[J]. Br J Ophthalmol, 2009, 93(9): 1134-1140. DOI:10.1136/bjo.2008.155267.
24、Zhang J, Wang N. Current challenges of retinal ganglion cell regeneration[J]. Regen Med, 2022, 17(4): 199-201. DOI:10.2217/rme-2022-0006. Zhang J, Wang N. Current challenges of retinal ganglion cell regeneration[J]. Regen Med, 2022, 17(4): 199-201. DOI:10.2217/rme-2022-0006.
25、Wang X, Sun L, Han X, et al. The molecular mechanisms underlying retinal ganglion cell apoptosis and optic nerve regeneration in glaucoma (Review)[J]. Int J Mol Med, 2025, 55(4). DOI:10.3892/ijmm.2025.5504. DOI:10.3892/ijmm.2025.5504. Wang X, Sun L, Han X, et al. The molecular mechanisms underlying retinal ganglion cell apoptosis and optic nerve regeneration in glaucoma (Review)[J]. Int J Mol Med, 2025, 55(4). DOI:10.3892/ijmm.2025.5504. DOI:10.3892/ijmm.2025.5504.
26、Yang SG, Li CP, Peng XQ, et al. Strategies to promote long-distance optic nerve regeneration[J]. Front Cell Neurosci, 2020: 119. DOI:10.3389/fncel.2020.00119. Yang SG, Li CP, Peng XQ, et al. Strategies to promote long-distance optic nerve regeneration[J]. Front Cell Neurosci, 2020: 119. DOI:10.3389/fncel.2020.00119.
27、de Lima S, Habboub G, Benowitz LI. Combinatorial therapy stimulates long-distance regeneration, target reinnervation, and partial recovery of vision after optic nerve injury in mice[J]. Int Rev Neurobiol, 2012, 106: 153-172. DOI:10.1016/B978-0-12-407178-0.00007-7. de Lima S, Habboub G, Benowitz LI. Combinatorial therapy stimulates long-distance regeneration, target reinnervation, and partial recovery of vision after optic nerve injury in mice[J]. Int Rev Neurobiol, 2012, 106: 153-172. DOI:10.1016/B978-0-12-407178-0.00007-7.
28、Zhang Q, Tang J, Liu L, et al. Emerging therapeutic strategies for optic nerve regeneration[J]. Trends Pharmacol Sci, 2025, 46(1): 45-61. DOI:10.1016/j.tips.2024.11.008. Zhang Q, Tang J, Liu L, et al. Emerging therapeutic strategies for optic nerve regeneration[J]. Trends Pharmacol Sci, 2025, 46(1): 45-61. DOI:10.1016/j.tips.2024.11.008.
29、Liu ZG, Zhou LY, Sun YQ, et al. Unlocking the potential for optic nerve regeneration over long distances: a multi-therapeutic intervention[J]. Front Neurol, 2025: 1526973-1526973. DOI:10.3389/fneur.2024.1526973. Liu ZG, Zhou LY, Sun YQ, et al. Unlocking the potential for optic nerve regeneration over long distances: a multi-therapeutic intervention[J]. Front Neurol, 2025: 1526973-1526973. DOI:10.3389/fneur.2024.1526973.
30、Scarabosio A, Surico PL, Tereshenko V, et al. Whole-eye transplantation: Current challenges and future perspectives[J]. World J Transplant, 2024, 14(2): 95009. DOI:10.5500/wjt.v14.i2.95009. Scarabosio A, Surico PL, Tereshenko V, et al. Whole-eye transplantation: Current challenges and future perspectives[J]. World J Transplant, 2024, 14(2): 95009. DOI:10.5500/wjt.v14.i2.95009.
31、Kaplan HJ. Anatomy and function of the eye[J]. Chem Immunol Allergy, 2007, 92: 4-10. DOI:10.1159/000099236. Kaplan HJ. Anatomy and function of the eye[J]. Chem Immunol Allergy, 2007, 92: 4-10. DOI:10.1159/000099236.
32、Hori J, Kunishige T, Nakano Y. Immune checkpoints contribute corneal immune privilege: implications for dry eye associated with checkpoint inhibitors[J]. Int J Mol Sci, 2020, 21(11): 3962. DOI:10.3390/ijms21113962. Hori J, Kunishige T, Nakano Y. Immune checkpoints contribute corneal immune privilege: implications for dry eye associated with checkpoint inhibitors[J]. Int J Mol Sci, 2020, 21(11): 3962. DOI:10.3390/ijms21113962.
33、Zor F, Karagoz H, Kapucu H, et al. Immunological considerations and concerns as pertinent to whole eye transplantation[J]. Curr Opin Organ Transplant, 2019, 24(6): 726-732. DOI:10.1097/MOT.0000000000000713. Zor F, Karagoz H, Kapucu H, et al. Immunological considerations and concerns as pertinent to whole eye transplantation[J]. Curr Opin Organ Transplant, 2019, 24(6): 726-732. DOI:10.1097/MOT.0000000000000713.
34、Kumar A, Yun H, Funderburgh ML, et al. Regenerative therapy for the cornea[J]. Prog Retin Eye Res, 2022, 87: 101011. DOI:10.1016/j.preteyeres.2021.101011. Kumar A, Yun H, Funderburgh ML, et al. Regenerative therapy for the cornea[J]. Prog Retin Eye Res, 2022, 87: 101011. DOI:10.1016/j.preteyeres.2021.101011.
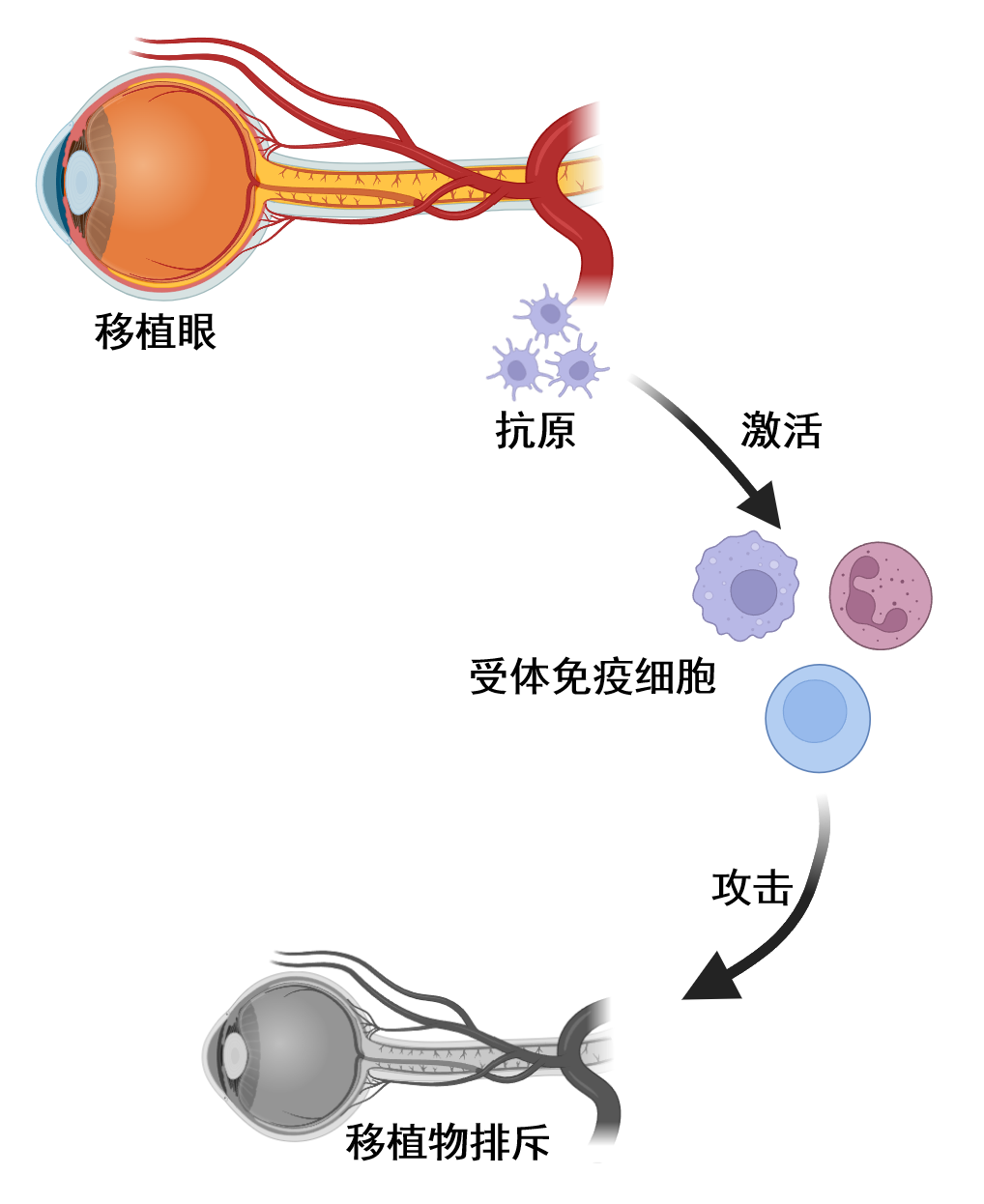
35、Li B, Wang Y, Owens CR, et al. Immune responses in rodent whole eye transplantation: elucidation and preliminary investigations into rejection diagnosis and monitoring[J]. Front Immunol, 2025, 16: 1475055. DOI:10.3389/fimmu.2025.1475055. Li B, Wang Y, Owens CR, et al. Immune responses in rodent whole eye transplantation: elucidation and preliminary investigations into rejection diagnosis and monitoring[J]. Front Immunol, 2025, 16: 1475055. DOI:10.3389/fimmu.2025.1475055.
36、Parlakpinar H, Gunata M. Transplantation and immunosuppression: a review of novel transplant-related immunosuppressant drugs[J]. Immunopharmacol Immunotoxicol, 2021, 43(6): 651-665. DOI:10.1080/08923973.2021.1966033.Parlakpinar H, Gunata M. Transplantation and immunosuppression: a review of novel transplant-related immunosuppressant drugs[J]. Immunopharmacol Immunotoxicol, 2021, 43(6): 651-665. DOI:10.1080/08923973.2021.1966033.
37、Peng J, Zhong L, Ma L, et al. Comparison of vascular parameters between normal cynomolgus macaques and healthy humans by optical coherence tomography angiography[J]. BMC Ophthalmol, 2019, 19(1): 204. DOI:10.1186/s12886-019-1207-x. Peng J, Zhong L, Ma L, et al. Comparison of vascular parameters between normal cynomolgus macaques and healthy humans by optical coherence tomography angiography[J]. BMC Ophthalmol, 2019, 19(1): 204. DOI:10.1186/s12886-019-1207-x.
38、Wozar F, Seitz I, Reichel F, et al. Importance of nonhuman Primates as a model system for gene therapy development in ophthalmology[J]. Klin Monbl Augenheilkd, 2022, 239(3): 270-274. DOI:10.1055/a-1777-5033. Wozar F, Seitz I, Reichel F, et al. Importance of nonhuman Primates as a model system for gene therapy development in ophthalmology[J]. Klin Monbl Augenheilkd, 2022, 239(3): 270-274. DOI:10.1055/a-1777-5033.
39、Seah I, Goh D, Chan HW, et al. Developing non-human primate models of inherited retinal diseases[J]. Genes, 2022, 13(2): 344. DOI:10.3390/genes13020344.
Seah I, Goh D, Chan HW, et al. Developing non-human primate models of inherited retinal diseases[J]. Genes, 2022, 13(2): 344. DOI:10.3390/genes13020344.