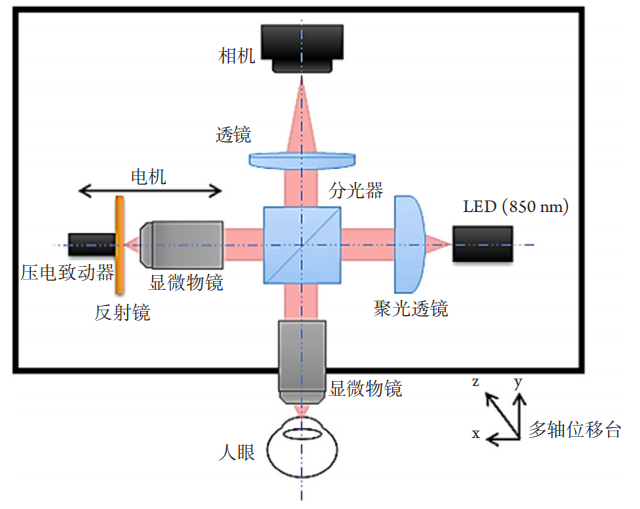
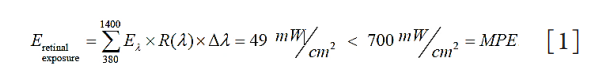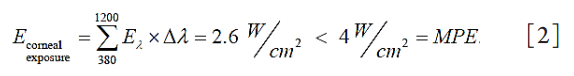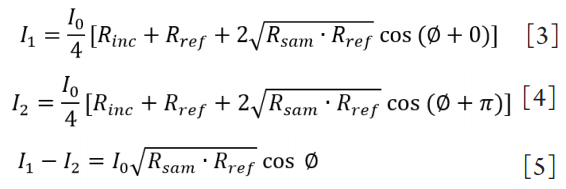1、Oliva MS, Schottman T, Gulati M. Turning the tide of corneal
blindness[ J]. Indian J Ophthalmol, 2012, 60(5): 423.Oliva MS, Schottman T, Gulati M. Turning the tide of corneal
blindness[ J]. Indian J Ophthalmol, 2012, 60(5): 423.
2、Pascolini D, Mariotti SP. Global estimates of visual impairment:
2010[ J]. Br J Ophthalmol, 2012, 96(5): 614-618.Pascolini D, Mariotti SP. Global estimates of visual impairment:
2010[ J]. Br J Ophthalmol, 2012, 96(5): 614-618.
3、Krachmer JH, Mannis MJ, Holland EJ. Cornea[M]. Oxford: Gulf
Professional Publishing, 2005.Krachmer JH, Mannis MJ, Holland EJ. Cornea[M]. Oxford: Gulf
Professional Publishing, 2005.
4、Ye Y, Jiang H, Zhang H, et al. Resolution of slit-lamp microscopy
photography using various cameras[ J]. Eye Contact Lens, 2013, 39(3):
205-213.Ye Y, Jiang H, Zhang H, et al. Resolution of slit-lamp microscopy
photography using various cameras[ J]. Eye Contact Lens, 2013, 39(3):
205-213.
5、Villani E, Baudouin C, Efron N, et al. In vivo confocal microscopy of
the ocular surface: from bench to bedside[ J]. Curr Eye Res, 2014,
39(3): 213-231.Villani E, Baudouin C, Efron N, et al. In vivo confocal microscopy of
the ocular surface: from bench to bedside[ J]. Curr Eye Res, 2014,
39(3): 213-231.
6、Hau SC, Dart JK, Vesaluoma M, et al. Diagnostic accuracy of microbial
keratitis with in vivo scanning laser confocal microscopy[ J]. Br J
Ophthalmol, 2010, 94(8): 982-987.Hau SC, Dart JK, Vesaluoma M, et al. Diagnostic accuracy of microbial
keratitis with in vivo scanning laser confocal microscopy[ J]. Br J
Ophthalmol, 2010, 94(8): 982-987.
7、Guthoff RF, Zhivov A, Stachs O. In vivo confocal microscopy, an inner
vision of the cornea–a major review[ J]. Clin Exp Ophthalmol, 2009,
37(1): 100-117.Guthoff RF, Zhivov A, Stachs O. In vivo confocal microscopy, an inner
vision of the cornea–a major review[ J]. Clin Exp Ophthalmol, 2009,
37(1): 100-117.
8、Huang D, Swanson EA , Lin CP, et al . Optical coherence
tomography[ J]. Science, 1991, 254(5035): 1178-1181.Huang D, Swanson EA , Lin CP, et al . Optical coherence
tomography[ J]. Science, 1991, 254(5035): 1178-1181.
9、Drexler W, Fujimoto JG. Optical coherence tomography: technology
and applications[M]. Springer Science & Business Media, 2008.Drexler W, Fujimoto JG. Optical coherence tomography: technology
and applications[M]. Springer Science & Business Media, 2008.
10、Ramos JL, Li Y, Huang D. Clinical and research applications of
anterior segment optical coherence tomography–a review[ J]. Clin Exp
Ophthalmol, 2009, 37(1): 81-89.Ramos JL, Li Y, Huang D. Clinical and research applications of
anterior segment optical coherence tomography–a review[ J]. Clin Exp
Ophthalmol, 2009, 37(1): 81-89.
11、Wang J, Abou Shousha M, Perez VL, et al. Ultra-high resolution optical
coherence tomography for imaging the anterior segment of the eye[ J].
Ophthalmic Surg Lasers Imaging, 2011, 42(4): S15-S27.Wang J, Abou Shousha M, Perez VL, et al. Ultra-high resolution optical
coherence tomography for imaging the anterior segment of the eye[ J].
Ophthalmic Surg Lasers Imaging, 2011, 42(4): S15-S27.
12、Bizheva K, Tan B, MacLelan B, et al. Sub-micrometer axial resolution
OCT for in-vivo imaging of the cellular structure of healthy and
keratoconic human corneas[ J]. Biomed Optics Express, 2017, 8(2):
800-812.Bizheva K, Tan B, MacLelan B, et al. Sub-micrometer axial resolution
OCT for in-vivo imaging of the cellular structure of healthy and
keratoconic human corneas[ J]. Biomed Optics Express, 2017, 8(2):
800-812.
13、Yadav R, Kottaiyan R, Ahmad K, et al. Epithelium and Bowman's
layer thickness and light scatter in keratoconic cornea evaluated using
ultrahigh resolution optical coherence tomography[ J]. J Biomed Opt,
2012, 17(11): 116010.Yadav R, Kottaiyan R, Ahmad K, et al. Epithelium and Bowman's
layer thickness and light scatter in keratoconic cornea evaluated using
ultrahigh resolution optical coherence tomography[ J]. J Biomed Opt,
2012, 17(11): 116010.
14、Dorairaj SK, Stewart MW. Clinical applications of AS-OCT for corneal
disease[ J]. Focus, 2014, 102(3):195-207.Dorairaj SK, Stewart MW. Clinical applications of AS-OCT for corneal
disease[ J]. Focus, 2014, 102(3):195-207.
15、Beaurepaire E, Boccara AC, Lebec M, et al. Full-field optical coherence
microscopy[ J]. Opt Lett, 1998, 23(4): 244-246.Beaurepaire E, Boccara AC, Lebec M, et al. Full-field optical coherence
microscopy[ J]. Opt Lett, 1998, 23(4): 244-246.
16、Dubois A. Handbook of full-field optical coherence microscopy:
Technology and applications[M]. Singapore: CRC Press, 2016.Dubois A. Handbook of full-field optical coherence microscopy:
Technology and applications[M]. Singapore: CRC Press, 2016.
17、Ghouali W, Grieve K, Bellefqih S, et al. Full-field optical coherence
tomography of human donor and pathological corneas[ J]. Curr Eye
Res, 2015, 40(5): 526-534.Ghouali W, Grieve K, Bellefqih S, et al. Full-field optical coherence
tomography of human donor and pathological corneas[ J]. Curr Eye
Res, 2015, 40(5): 526-534.
18、Xiao P, Fink M, Boccara AC. Full-field spatially incoherent illumination
interferometry: a spatial resolution almost insensitive to aberrations[ J].
Opt Lett, 2016, 41(17): 3920-3923.Xiao P, Fink M, Boccara AC. Full-field spatially incoherent illumination
interferometry: a spatial resolution almost insensitive to aberrations[ J].
Opt Lett, 2016, 41(17): 3920-3923.
19、Template matching and slice alignment—ImageJ Plugins[EB/OL].
[2016-06-15]. https://sites.google.com/site/qingzongtseng/template-
matching-ij-plugin.Template matching and slice alignment—ImageJ Plugins[EB/OL].
[2016-06-15]. https://sites.google.com/site/qingzongtseng/template-
matching-ij-plugin.