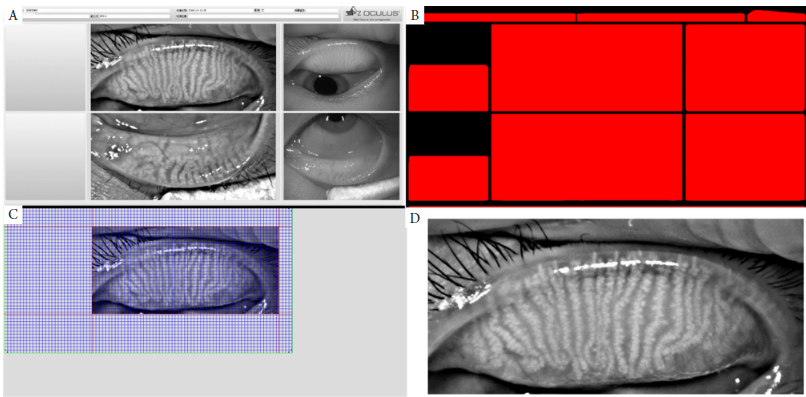
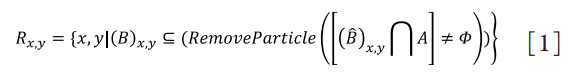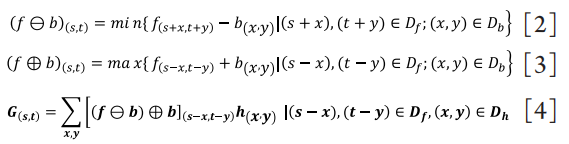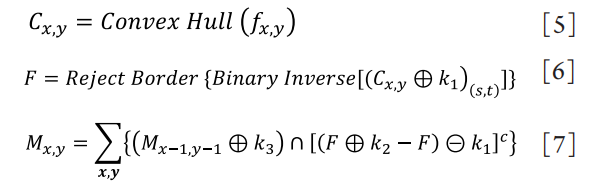1、王玉倩, 董诺, 吴护平. 睑板腺形态学的研究进展[ J]. 中华眼科
杂志, 2014, 50(4): 299-302.
WANG Yuqian, DONG Nuo, WU Huping. Meibomian gland
morphology study progression[ J]. Chinese Journal of Ophthalmology,
2014, 50(4): 299-302.王玉倩, 董诺, 吴护平. 睑板腺形态学的研究进展[ J]. 中华眼科
杂志, 2014, 50(4): 299-302.
WANG Yuqian, DONG Nuo, WU Huping. Meibomian gland
morphology study progression[ J]. Chinese Journal of Ophthalmology,
2014, 50(4): 299-302.
2、Knop N, Knop E. Meibomian glands. Part I: anatomy, embryology,
and histology of the Meibomian glands[ J]. Der Ophthalmologe, 2009,
106(10): 872-883.Knop N, Knop E. Meibomian glands. Part I: anatomy, embryology,
and histology of the Meibomian glands[ J]. Der Ophthalmologe, 2009,
106(10): 872-883.
3、Wise RJ, Sobel RK, Allen RC. Meibography: A review of techniques
and technologies[ J]. Saudi J Ophthalmol, 2012, 26(4): 349-356.Wise RJ, Sobel RK, Allen RC. Meibography: A review of techniques
and technologies[ J]. Saudi J Ophthalmol, 2012, 26(4): 349-356.
4、Lemp MA, Crews LA, Bron AJ, et al. Distribution of aqueous-deficient
and evaporative dry eye in a clinic-based patient cohort: a retrospective
study[ J]. Cornea, 2012, 31(5): 472-478.Lemp MA, Crews LA, Bron AJ, et al. Distribution of aqueous-deficient
and evaporative dry eye in a clinic-based patient cohort: a retrospective
study[ J]. Cornea, 2012, 31(5): 472-478.
5、洪晶. 提高对睑板腺功能障碍的认识 重视睑板腺功能障碍
相关性干眼的药物治疗[ J]. 中华实验眼科杂志, 2012, 30(10):
865-868.
HONG Jing. Improving the understanding for Meibomian gland
dysfunction Paying attention to the management of Meibomian gland
dysfunction associated-dry eye[ J]. Chinese Journal of Experimental
Ophthalmology, 2012, 30(10): 865-868.洪晶. 提高对睑板腺功能障碍的认识 重视睑板腺功能障碍
相关性干眼的药物治疗[ J]. 中华实验眼科杂志, 2012, 30(10):
865-868.
HONG Jing. Improving the understanding for Meibomian gland
dysfunction Paying attention to the management of Meibomian gland
dysfunction associated-dry eye[ J]. Chinese Journal of Experimental
Ophthalmology, 2012, 30(10): 865-868.
6、Baudouin C, Messmer EM, Aragona P, et al. Revisiting the vicious
circle of dry eye disease: a focus on the pathophysiology of meibomian
gland dysfunction[ J]. Br J Ophthalmol, 2016, 100(3): 300-306.Baudouin C, Messmer EM, Aragona P, et al. Revisiting the vicious
circle of dry eye disease: a focus on the pathophysiology of meibomian
gland dysfunction[ J]. Br J Ophthalmol, 2016, 100(3): 300-306.
7、Srinivasan S, Menzies K , Sorbara L, et al. Infrared imaging of
meibomian gland structure using a novel keratography[ J]. Optom Vis
Sci, 2012, 89(5): 788-794.Srinivasan S, Menzies K , Sorbara L, et al. Infrared imaging of
meibomian gland structure using a novel keratography[ J]. Optom Vis
Sci, 2012, 89(5): 788-794.
8、Arita R, Suehiro J, Haraguchi T, et al. Objective image analysis of the
meibomian gland area[ J]. Br J Ophthalmol, 2014, 98(6): 746-755.Arita R, Suehiro J, Haraguchi T, et al. Objective image analysis of the
meibomian gland area[ J]. Br J Ophthalmol, 2014, 98(6): 746-755.
9、段宇飞, 王巧华, 李小明, 等. 基于凸包算法的鸡蛋尺寸形状在线
视觉高通量检测方法[ J]. 农业工程学报, 2016, 32(15): 282-288.
DUAN Yufei, WANG Qiaohua, LI Xiaoming, et al. High-throughput
online detection method of egg size and shape based on convex hull
algorithm[ J]. Transactions of the Chinese Society of Agricultural
Engineering, 2016, 32(15): 282-288.段宇飞, 王巧华, 李小明, 等. 基于凸包算法的鸡蛋尺寸形状在线
视觉高通量检测方法[ J]. 农业工程学报, 2016, 32(15): 282-288.
DUAN Yufei, WANG Qiaohua, LI Xiaoming, et al. High-throughput
online detection method of egg size and shape based on convex hull
algorithm[ J]. Transactions of the Chinese Society of Agricultural
Engineering, 2016, 32(15): 282-288.
10、陈虎, 周朝辉, 王守尊. 基于数学形态学的图像去噪方法研
究[ J]. 工程图学学报, 2004, 25(2): 116-119.
CHEN Hu, ZHOU Zhaohui, WANG Shouzun. Research based
mathematics morphology image chirp method[ J]. Journal of
Engineering Graphics, 2004, 25(2):116-119.陈虎, 周朝辉, 王守尊. 基于数学形态学的图像去噪方法研
究[ J]. 工程图学学报, 2004, 25(2): 116-119.
CHEN Hu, ZHOU Zhaohui, WANG Shouzun. Research based
mathematics morphology image chirp method[ J]. Journal of
Engineering Graphics, 2004, 25(2):116-119.
11、Knop E, Knop N, Sul l ivan DA . A natomy, physiolog y and
pathophysiology of the meibomian gland[ J]. Acta Ophthalmologica,
2012, 90: 4271.Knop E, Knop N, Sul l ivan DA . A natomy, physiolog y and
pathophysiology of the meibomian gland[ J]. Acta Ophthalmologica,
2012, 90: 4271.
12、李枫. 图像分析中光密度参数物理意义的正确理解和使用[ J].
解剖学杂志, 2009, 32(2): 271-274.
LI Feng. Correct understanding and use of optical density parameters
in image analysis[ J]. Chinese Journal of Anatomy, 2009, 32(2):
271-274.李枫. 图像分析中光密度参数物理意义的正确理解和使用[ J].
解剖学杂志, 2009, 32(2): 271-274.
LI Feng. Correct understanding and use of optical density parameters
in image analysis[ J]. Chinese Journal of Anatomy, 2009, 32(2):
271-274.
13、李朋军, 夏潮涌. 肿瘤细胞DNA干系倍体分析及其临床应用[ J].
中国体视学与图像分析, 2005, 10(2): 72-76.
LI Pengjun, XIA Chaoyong. Analysis and clinical application of DNA
stemline ploidy of tumor cells[ J]. Chinese Journal of Stereology and
Image Analysis, 2005, 10(2): 72-76.李朋军, 夏潮涌. 肿瘤细胞DNA干系倍体分析及其临床应用[ J].
中国体视学与图像分析, 2005, 10(2): 72-76.
LI Pengjun, XIA Chaoyong. Analysis and clinical application of DNA
stemline ploidy of tumor cells[ J]. Chinese Journal of Stereology and
Image Analysis, 2005, 10(2): 72-76.