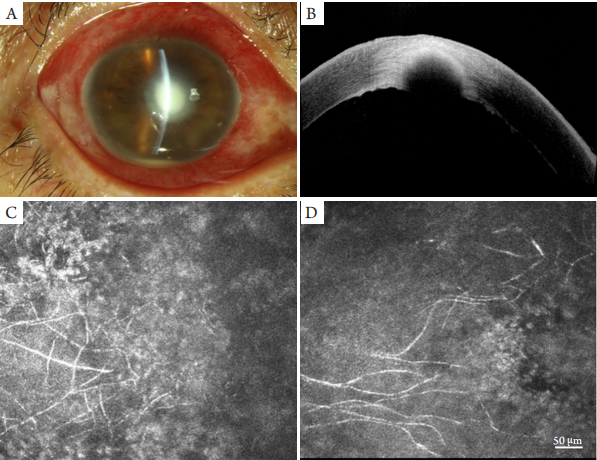
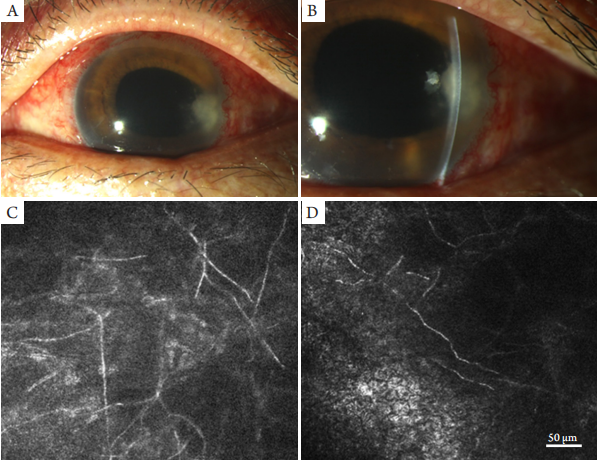
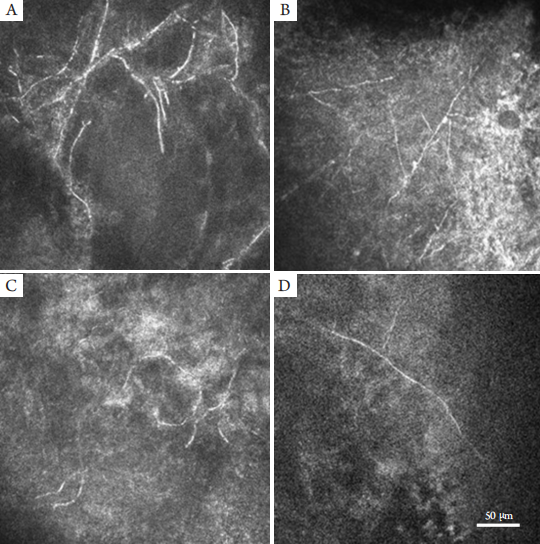
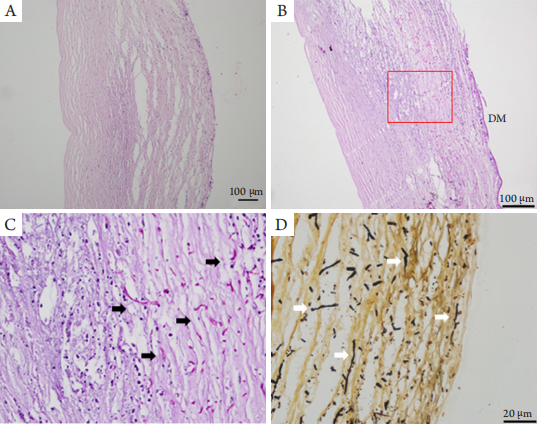
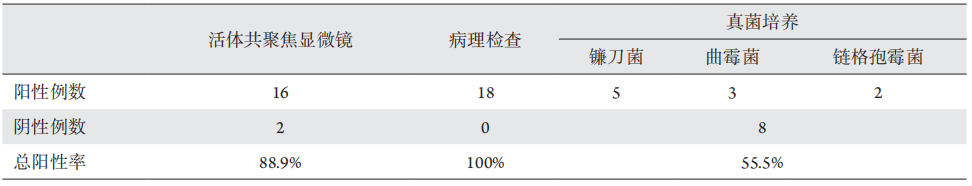
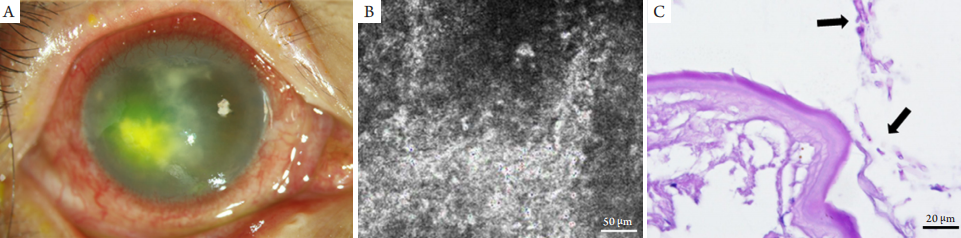
1、Xie L, Zhong W, Shi W, et al. Spectrum of fungal keratitis in north
China[ J]. Ophthalmology, 2006, 113(11): 1943-1948.Xie L, Zhong W, Shi W, et al. Spectrum of fungal keratitis in north
China[ J]. Ophthalmology, 2006, 113(11): 1943-1948.
2、Erie JC,Mc Laren JW, Pate l SV.Confocal microscopy in
ophthalmology[ J]. Am J Ophthalmol, 2009, 148(5): 639-646.Erie JC,Mc Laren JW, Pate l SV.Confocal microscopy in
ophthalmology[ J]. Am J Ophthalmol, 2009, 148(5): 639-646.
3、Niederer RL, McGhee CN. Clinical in vivo confocal microscopy of
the human cornea in health and disease[ J]. Prog Retin Eye Res, 2010,
29(1): 30-58.Niederer RL, McGhee CN. Clinical in vivo confocal microscopy of
the human cornea in health and disease[ J]. Prog Retin Eye Res, 2010,
29(1): 30-58.
4、刘瑞, 李冰, 徐鼎, 等. 活体共聚焦显微镜观察视网膜激光光凝术
对角膜上皮下神经的影响[ J]. 眼科学报, 2018, 33(2): 101-107.
LIU R, LI B, XU D, et al. Effect of retinal photocoagulation on
corneal sub-basal nerve observed by in vivo confocal microscopy[ J].
Yan Ke Xue Bao, 2018, 33(2): 101-107.刘瑞, 李冰, 徐鼎, 等. 活体共聚焦显微镜观察视网膜激光光凝术
对角膜上皮下神经的影响[ J]. 眼科学报, 2018, 33(2): 101-107.
LIU R, LI B, XU D, et al. Effect of retinal photocoagulation on
corneal sub-basal nerve observed by in vivo confocal microscopy[ J].
Yan Ke Xue Bao, 2018, 33(2): 101-107.
5、Villani E, Baudouin C, Efron N, et al. In vivo confocal microscopy of
the ocular surface: from bench to bedside[ J]. Curr Eye Res, 2014,
39(3): 213-231.Villani E, Baudouin C, Efron N, et al. In vivo confocal microscopy of
the ocular surface: from bench to bedside[ J]. Curr Eye Res, 2014,
39(3): 213-231.
6、王楠, 赵桂秋, 高昂, 等. 刮片镜检法联合激光扫描共焦显微镜快
速诊断真菌性角膜炎的临床评价[ J]. 中华实验眼科杂志, 2013,
31(5): 493-495.
WANG N, ZHAO GQ, GAO A, et al. Clinical evaluation
of rapid diagnosis of fungal keratitis by the combination of corneal
scraping with laser scanning confocal microscopy[ J]. Chinese Journal
of Experimental Ophthalmology, 2013, 31(5): 493-495.王楠, 赵桂秋, 高昂, 等. 刮片镜检法联合激光扫描共焦显微镜快
速诊断真菌性角膜炎的临床评价[ J]. 中华实验眼科杂志, 2013,
31(5): 493-495.
WANG N, ZHAO GQ, GAO A, et al. Clinical evaluation
of rapid diagnosis of fungal keratitis by the combination of corneal
scraping with laser scanning confocal microscopy[ J]. Chinese Journal
of Experimental Ophthalmology, 2013, 31(5): 493-495.
7、Chiou AG, Kaufman SC, Kaufman HE, et al. Clinical corneal confocal
microscopy[ J]. Surv Ophthalmol, 2006, 51(5): 482-500.Chiou AG, Kaufman SC, Kaufman HE, et al. Clinical corneal confocal
microscopy[ J]. Surv Ophthalmol, 2006, 51(5): 482-500.
8、Thomas PA, Kaliamurthy J. Mycotic keratitis: epidemiology, diagnosis
and management[ J]. Clin Microbiol Infect, 2013, 19(3): 210-220.Thomas PA, Kaliamurthy J. Mycotic keratitis: epidemiology, diagnosis
and management[ J]. Clin Microbiol Infect, 2013, 19(3): 210-220.
9、Chidambaram JD, Prajna NV, Palepu S, et al. In vivo confocal
microscopy cellular features of host and organism in bacterial,
fungal, and acanthamoeba keratitis[ J]. Am J Ophthalmol, 2018,
190(6): 24-33.Chidambaram JD, Prajna NV, Palepu S, et al. In vivo confocal
microscopy cellular features of host and organism in bacterial,
fungal, and acanthamoeba keratitis[ J]. Am J Ophthalmol, 2018,
190(6): 24-33.
10、史伟云, 牛晓光, 王富华, 等. 真菌性角膜炎药物治疗后转归的共
焦显微镜观察[ J]. 中华眼科杂志, 2005, 41(7): 614-619.
SHI WY, NIU XG, WANG FH, et al. Evaluation of
antifungal chemotherapeutic effects on fungal keratitis by confocal
microscopy[ J]. Chinese Journal of Ophthalmology, 2005, 41(7):
614-619.史伟云, 牛晓光, 王富华, 等. 真菌性角膜炎药物治疗后转归的共
焦显微镜观察[ J]. 中华眼科杂志, 2005, 41(7): 614-619.
SHI WY, NIU XG, WANG FH, et al. Evaluation of
antifungal chemotherapeutic effects on fungal keratitis by confocal
microscopy[ J]. Chinese Journal of Ophthalmology, 2005, 41(7):
614-619.
11、程钧, 翟华蕾, 王君怡, 等. 角膜后部真菌感染的临床特点和治疗
策略[ J]. 中华眼科杂志, 2017, 53(10): 758-765.
CHENG J, ZHAI HL, WANG JY, et al. Clinical features and
treatments of retrocorneal fungal infection[ J]. Chinese Journal of
Ophthalmology, 2017, 53(10): 758-765.程钧, 翟华蕾, 王君怡, 等. 角膜后部真菌感染的临床特点和治疗
策略[ J]. 中华眼科杂志, 2017, 53(10): 758-765.
CHENG J, ZHAI HL, WANG JY, et al. Clinical features and
treatments of retrocorneal fungal infection[ J]. Chinese Journal of
Ophthalmology, 2017, 53(10): 758-765.
12、梁庆丰, 孙旭光, Antoine L. 活体共聚焦显微镜在感染性角膜炎
诊治中的应用[ J]. 中华眼科杂志, 2013, 49(10): 951-955.
LIANG QF, SUN XG, LABBE Antoine. Role of in vivo
confocal microscopy in the management of infectious keratitis[ J].
Chinese Journal of Ophthalmology, 2013, 49(10): 951-955.梁庆丰, 孙旭光, Antoine L. 活体共聚焦显微镜在感染性角膜炎
诊治中的应用[ J]. 中华眼科杂志, 2013, 49(10): 951-955.
LIANG QF, SUN XG, LABBE Antoine. Role of in vivo
confocal microscopy in the management of infectious keratitis[ J].
Chinese Journal of Ophthalmology, 2013, 49(10): 951-955.
13、Kanavi MR, Javadi M, Yazdani S, et al. Sensitivity and specificity of
confocal scan in the diagnosis of infectious keratitis[ J]. Cornea, 2007,
26(7): 782-786.Kanavi MR, Javadi M, Yazdani S, et al. Sensitivity and specificity of
confocal scan in the diagnosis of infectious keratitis[ J]. Cornea, 2007,
26(7): 782-786.
14、Chidambaram JD, Prajna NV, Larke NL, et al. Prospective study
of the diagnostic accuracy of the in vivo laser scanning confocal
microscope for severe microbial keratitis[ J]. Ophthalmology, 2016,
123(11): 2285-2293.Chidambaram JD, Prajna NV, Larke NL, et al. Prospective study
of the diagnostic accuracy of the in vivo laser scanning confocal
microscope for severe microbial keratitis[ J]. Ophthalmology, 2016,
123(11): 2285-2293.
15、高欢欢, 张平, 林健贤, 等. 三种特殊染色方法在角结膜原位癌基
底膜染色中的应用[ J]. 眼科学报, 2018, 33(1): 32-36.
GAO HH, ZHANG P, LIN JX, et al. Application of
three special staining methods in the basement membranes in corneal
and conjunctival carcinoma in situ[ J]. Eye Science, 2018, 33(1): 32-36.高欢欢, 张平, 林健贤, 等. 三种特殊染色方法在角结膜原位癌基
底膜染色中的应用[ J]. 眼科学报, 2018, 33(1): 32-36.
GAO HH, ZHANG P, LIN JX, et al. Application of
three special staining methods in the basement membranes in corneal
and conjunctival carcinoma in situ[ J]. Eye Science, 2018, 33(1): 32-36.
16、Kheirkhah A, Syed ZA, Satitpitakul V, et al. Sensitivity and specificity
of laser-scanning in vivo confocal microscopy for filamentous fungal
keratitis: role of observer experience[ J]. Am J Ophthalmol, 2017,
179(7): 81-89.Kheirkhah A, Syed ZA, Satitpitakul V, et al. Sensitivity and specificity
of laser-scanning in vivo confocal microscopy for filamentous fungal
keratitis: role of observer experience[ J]. Am J Ophthalmol, 2017,
179(7): 81-89.
17、Winchester K, Mathers WD, Sutphin JE. Diagnosis of Aspergillus
keratitis in vivo with confocal microscopy[ J]. Cornea, 1997, 16(1):
27-31.Winchester K, Mathers WD, Sutphin JE. Diagnosis of Aspergillus
keratitis in vivo with confocal microscopy[ J]. Cornea, 1997, 16(1):
27-31.
18、Chidambaram JD, Prajna NV, Larke N, et al. In vivo confocal
microscopy appearance of Fusarium and Aspergillus species in fungal
keratitis[ J]. Br J Ophthalmol, 2017, 101(8): 1119-1123.Chidambaram JD, Prajna NV, Larke N, et al. In vivo confocal
microscopy appearance of Fusarium and Aspergillus species in fungal
keratitis[ J]. Br J Ophthalmol, 2017, 101(8): 1119-1123.