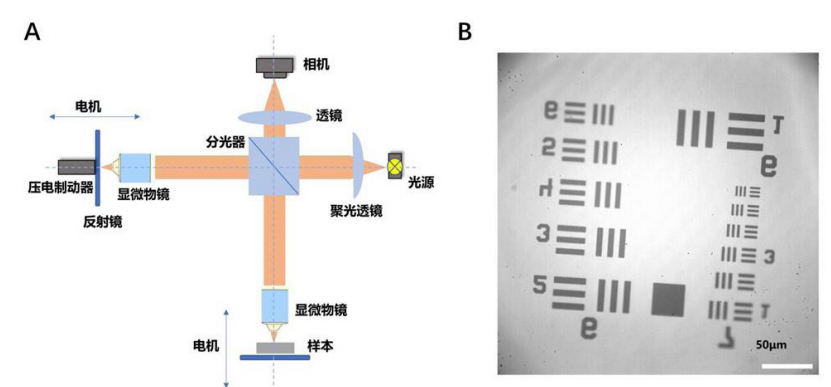
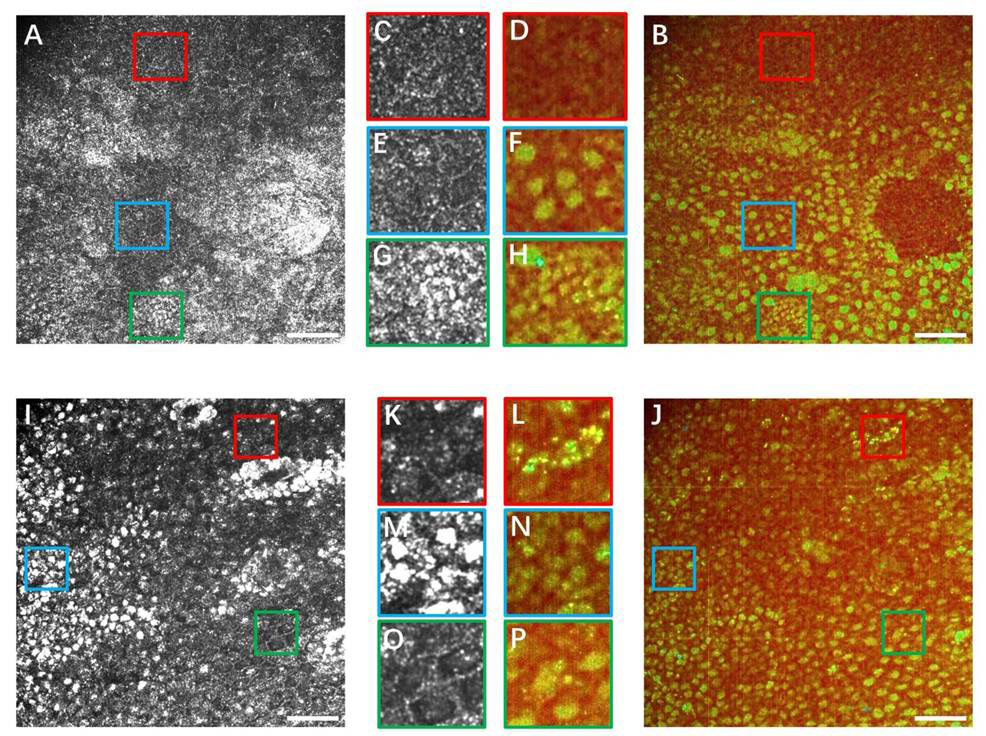
1、Van Buskirk EM. The anatomy of the limbus[ J]. Eye, 1989, 3( Pt 2):
101-108. DOI: 10.1038/eye.1989.16.Van Buskirk EM. The anatomy of the limbus[ J]. Eye, 1989, 3( Pt 2):
101-108. DOI: 10.1038/eye.1989.16.
2、Huang AJ, Tseng SC. Corneal epithelial wound healing in the absence
of limbal epithelium[ J]. Invest Ophthalmol Vis Sci, 1991, 32(1): 96-
105.Huang AJ, Tseng SC. Corneal epithelial wound healing in the absence
of limbal epithelium[ J]. Invest Ophthalmol Vis Sci, 1991, 32(1): 96-
105.
3、Le Q, Xu J, Deng SX. The diagnosis of limbal stem cell deficiency[ J].
Ocul Surf, 2018, 16(1): 58-69. DOI: 10.1016/j.jtos.2017.11.002.Le Q, Xu J, Deng SX. The diagnosis of limbal stem cell deficiency[ J].
Ocul Surf, 2018, 16(1): 58-69. DOI: 10.1016/j.jtos.2017.11.002.
4、Tseng SC. Concept and application of limbal stem cells[ J]. Eye, 1989,
3( Pt 2): 141-157. DOI: 10.1038/eye.1989.22.Tseng SC. Concept and application of limbal stem cells[ J]. Eye, 1989,
3( Pt 2): 141-157. DOI: 10.1038/eye.1989.22.
5、Deng SX , Borderie V, Chan CC, et al. Global consensus on
definition, classification, diagnosis, and staging of limbal stem cell
deficiency[ J]. Cornea, 2019, 38(3): 364-375. DOI: 10.1097/
ICO.0000000000001820.Deng SX , Borderie V, Chan CC, et al. Global consensus on
definition, classification, diagnosis, and staging of limbal stem cell
deficiency[ J]. Cornea, 2019, 38(3): 364-375. DOI: 10.1097/
ICO.0000000000001820.
6、Chan EH, Chen L, Rao JY, et al. Limbal basal cell density decreases in
limbal stem cell deficiency[ J]. Am J Ophthalmol, 2015, 160(4): 678-
684.e4. DOI: 10.1016/j.ajo.2015.06.026.Chan EH, Chen L, Rao JY, et al. Limbal basal cell density decreases in
limbal stem cell deficiency[ J]. Am J Ophthalmol, 2015, 160(4): 678-
684.e4. DOI: 10.1016/j.ajo.2015.06.026.
7、Feng Y, Simpson TL. Comparison of human central cornea and limbus
in vivo using optical coherence tomography[ J]. Optom Vis Sci, 2005,
82(5): 416-419. DOI: 10.1097/01.opx.0000162649.97059.72.Feng Y, Simpson TL. Comparison of human central cornea and limbus
in vivo using optical coherence tomography[ J]. Optom Vis Sci, 2005,
82(5): 416-419. DOI: 10.1097/01.opx.0000162649.97059.72.
8、Ang M, Sim DA, Keane PA, et al. Optical coherence tomography
ang iography for anter ior segment vasculature imag ing[ J].
Ophthalmology, 2015, 122(9): 1740-1747. DOI: 10.1016/
j.ophtha.2015.05.017.Ang M, Sim DA, Keane PA, et al. Optical coherence tomography
ang iography for anter ior segment vasculature imag ing[ J].
Ophthalmology, 2015, 122(9): 1740-1747. DOI: 10.1016/
j.ophtha.2015.05.017.
9、Beaurepaire E, Boccara AC, Lebec M, et al. Full-field optical coherence
microscopy[ J]. Opt Lett, 1998, 23(4): 244-246. DOI: 10.1364/
ol.23.000244.Beaurepaire E, Boccara AC, Lebec M, et al. Full-field optical coherence
microscopy[ J]. Opt Lett, 1998, 23(4): 244-246. DOI: 10.1364/
ol.23.000244.
10、Akiba M, Maeda N, Yumikake K, et al. Ultrahigh-resolution imaging of
human donor cornea using full-field optical coherence tomography[ J].
J Biomed Opt, 2007, 12(4): 041202. DOI: 10.1117/1.2764461.Akiba M, Maeda N, Yumikake K, et al. Ultrahigh-resolution imaging of
human donor cornea using full-field optical coherence tomography[ J].
J Biomed Opt, 2007, 12(4): 041202. DOI: 10.1117/1.2764461.
11、Ghouali W, Grieve K, Bellefqih S, et al. Full-field optical coherence
tomography of human donor and pathological corneas[ J]. Curr Eye
Res, 2015, 40(5): 526-534. DOI: 10.3109/02713683.2014.935444.Ghouali W, Grieve K, Bellefqih S, et al. Full-field optical coherence
tomography of human donor and pathological corneas[ J]. Curr Eye
Res, 2015, 40(5): 526-534. DOI: 10.3109/02713683.2014.935444.
12、Grieve K, Paques M, Dubois A, et al. Ocular tissue imaging using
ultrahigh-resolution, full-field optical coherence tomography[ J]. Invest
Ophthalmol Vis Sci, 2004, 45(11): 4126-4131. DOI: 10.1167/iovs.04-
0584.Grieve K, Paques M, Dubois A, et al. Ocular tissue imaging using
ultrahigh-resolution, full-field optical coherence tomography[ J]. Invest
Ophthalmol Vis Sci, 2004, 45(11): 4126-4131. DOI: 10.1167/iovs.04-
0584.
13、Grieve K, Georgeon C, Andreiuolo F, et al. Imaging microscopic
features of keratoconic corneal morphology[ J]. Cornea, 2016, 35(12):
1621-1630. DOI: 10.1097/ICO.0000000000000979.Grieve K, Georgeon C, Andreiuolo F, et al. Imaging microscopic
features of keratoconic corneal morphology[ J]. Cornea, 2016, 35(12):
1621-1630. DOI: 10.1097/ICO.0000000000000979.
14、Apelian C, Harms F, Thouvenin O, et al. Dynamic full field optical
coherence tomography: subcellular metabolic contrast revealed in
tissues by interferometric signals temporal analysis[ J]. Biomed Opt
Express, 2016, 7(4): 1511-1524. DOI: 10.1364/BOE.7.001511.Apelian C, Harms F, Thouvenin O, et al. Dynamic full field optical
coherence tomography: subcellular metabolic contrast revealed in
tissues by interferometric signals temporal analysis[ J]. Biomed Opt
Express, 2016, 7(4): 1511-1524. DOI: 10.1364/BOE.7.001511.
15、Scholler J, Groux K, Goureau O, et al. Dynamic full-field optical
coherence tomography: 3D live-imaging of retinal organoids[ J]. Light
Sci Appl, 2020, 9: 140. DOI: 10.1038/s41377-020-00375-8.Scholler J, Groux K, Goureau O, et al. Dynamic full-field optical
coherence tomography: 3D live-imaging of retinal organoids[ J]. Light
Sci Appl, 2020, 9: 140. DOI: 10.1038/s41377-020-00375-8.
16、Groux K , Verschueren A, Nanteau C, et al. Dynamic full-field
optical coherence tomography allows live imaging of retinal pigment
epithelium stress model[ J]. Commun Biol, 2022, 5(1): 575. DOI:
10.1038/s42003-022-03479-6.Groux K , Verschueren A, Nanteau C, et al. Dynamic full-field
optical coherence tomography allows live imaging of retinal pigment
epithelium stress model[ J]. Commun Biol, 2022, 5(1): 575. DOI:
10.1038/s42003-022-03479-6.
17、Park S, Nguyen T, Benoit E, et al. Quantitative evaluation of the
dynamic activity of HeLa cells in different viability states using dynamic
full-field optical coherence microscopy[ J]. Biomed Opt Express, 2021,
12(10): 6431-6441. DOI: 10.1364/BOE.436330.Park S, Nguyen T, Benoit E, et al. Quantitative evaluation of the
dynamic activity of HeLa cells in different viability states using dynamic
full-field optical coherence microscopy[ J]. Biomed Opt Express, 2021,
12(10): 6431-6441. DOI: 10.1364/BOE.436330.
18、Hu a ng D, Sw a n s o n E A , L i n CP, e t a l . O p t i c a l c o h e re n c e
tomography[ J]. Science, 1991, 254(5035): 1178-1181. DOI: 10.1126/
science.1957169.Hu a ng D, Sw a n s o n E A , L i n CP, e t a l . O p t i c a l c o h e re n c e
tomography[ J]. Science, 1991, 254(5035): 1178-1181. DOI: 10.1126/
science.1957169.
19、Villani E, Baudouin C, Efron N, et al. In vivo confocal microscopy of
the ocular surface: from bench to bedside[ J]. Curr Eye Res, 2014,
39(3): 213-231. DOI: 10.3109/02713683.2013.842592.Villani E, Baudouin C, Efron N, et al. In vivo confocal microscopy of
the ocular surface: from bench to bedside[ J]. Curr Eye Res, 2014,
39(3): 213-231. DOI: 10.3109/02713683.2013.842592.
20、Guthoff RF, Zhivov A, Stachs O. In vivo confocal microscopy, an inner
vision of the cornea - a major review[ J]. Clin Exp Ophthalmol, 2009,
37(1): 100-117. DOI: 10.1111/j.1442-9071.2009.02016.x.Guthoff RF, Zhivov A, Stachs O. In vivo confocal microscopy, an inner
vision of the cornea - a major review[ J]. Clin Exp Ophthalmol, 2009,
37(1): 100-117. DOI: 10.1111/j.1442-9071.2009.02016.x.
21、Kiepas A, Voorand E, Mubaid F, et al. Optimizing live-cell fluorescence
imaging conditions to minimize phototoxicity[ J]. J Cell Sci, 2020,
133(4): jcs242834. DOI: 10.1242/jcs.242834.Kiepas A, Voorand E, Mubaid F, et al. Optimizing live-cell fluorescence
imaging conditions to minimize phototoxicity[ J]. J Cell Sci, 2020,
133(4): jcs242834. DOI: 10.1242/jcs.242834.
22、Sanderson MJ, Smith I, Parker I, et al. Fluorescence microscopy[ J].
Cold Spring Harb Protoc, 2014, 2014(10): pdb.top071795. DOI:
10.1101/pdb.top071795.Sanderson MJ, Smith I, Parker I, et al. Fluorescence microscopy[ J].
Cold Spring Harb Protoc, 2014, 2014(10): pdb.top071795. DOI:
10.1101/pdb.top071795.
23、Dubois A. Handbook of full-field optical coherence microscopy:
technology and applications[M]. CA: Pan Stanford, 2016.Dubois A. Handbook of full-field optical coherence microscopy:
technology and applications[M]. CA: Pan Stanford, 2016.
24、Scholler J, Mazlin V, Thouvenin O, et al. Probing dynamic processes in
the eye at multiple spatial and temporal scales with multimodal full field
OCT[ J]. Biomed Opt Express, 2019, 10(2): 731-746. DOI: 10.1364/
BOE.10.000731.Scholler J, Mazlin V, Thouvenin O, et al. Probing dynamic processes in
the eye at multiple spatial and temporal scales with multimodal full field
OCT[ J]. Biomed Opt Express, 2019, 10(2): 731-746. DOI: 10.1364/
BOE.10.000731.
25、Dubois A. Focus defect and dispersion mismatch in full-field optical
coherence microscopy[ J]. Appl Opt, 2017, 56(9): D142-D150. DOI:
10.1364/AO.56.00D142.Dubois A. Focus defect and dispersion mismatch in full-field optical
coherence microscopy[ J]. Appl Opt, 2017, 56(9): D142-D150. DOI:
10.1364/AO.56.00D142.
26、Labiau S, David G, Gigan S, et al. Defocus test and defocus correction
in full-field optical coherence tomography[ J]. Opt Lett, 2009, 34(10):
1576-1578. DOI: 10.1364/ol.34.001576.Labiau S, David G, Gigan S, et al. Defocus test and defocus correction
in full-field optical coherence tomography[ J]. Opt Lett, 2009, 34(10):
1576-1578. DOI: 10.1364/ol.34.001576.
27、Dziasko MA, Daniels JT. Anatomical features and cell-cell interactions
inthe human limbal epithelial stem cell niche[ J]. Ocul Surf, 2016,
14(3): 322-330. DOI: 10.1016/j.jtos.2016.04.002.Dziasko MA, Daniels JT. Anatomical features and cell-cell interactions
inthe human limbal epithelial stem cell niche[ J]. Ocul Surf, 2016,
14(3): 322-330. DOI: 10.1016/j.jtos.2016.04.002.
28、de Almeida Fuzeta M, de Matos Branco AD, Fernandes-Platzgummer
A, et al. Addressing the manufacturing challenges of cell-based
therapies[ J]. Adv Biochem Eng Biotechnol, 2020, 171: 225-278. DOI:
10.1007/10_2019_118.de Almeida Fuzeta M, de Matos Branco AD, Fernandes-Platzgummer
A, et al. Addressing the manufacturing challenges of cell-based
therapies[ J]. Adv Biochem Eng Biotechnol, 2020, 171: 225-278. DOI:
10.1007/10_2019_118.
29、Araújo AL, Ricardo JR, Sakai VN, et al. Impression cytology and
in vivo confocal microscopy in corneas with total limbal stem cell
deficiency[ J]. Arq Bras Oftalmol, 2013, 76(5): 305-308. DOI:
10.1590/s0004-27492013000500011.Araújo AL, Ricardo JR, Sakai VN, et al. Impression cytology and
in vivo confocal microscopy in corneas with total limbal stem cell
deficiency[ J]. Arq Bras Oftalmol, 2013, 76(5): 305-308. DOI:
10.1590/s0004-27492013000500011.
30、Kate A, Basu. A review of the diagnosis and treatment of limbal stem
cell deficiency[ J]. Front Med, 2022, 9: 836009. DOI: 10.3389/
fmed.2022.836009.Kate A, Basu. A review of the diagnosis and treatment of limbal stem
cell deficiency[ J]. Front Med, 2022, 9: 836009. DOI: 10.3389/
fmed.2022.836009.
31、Kureshi AK, Drake RA, Daniels JT. Challenges in the development of
a reference standard and potency assay for the clinical production of
RAFT tissue equivalents for the cornea[ J]. Regen Med, 2014, 9(2):
167-177. DOI: 10.2217/rme.13.92.Kureshi AK, Drake RA, Daniels JT. Challenges in the development of
a reference standard and potency assay for the clinical production of
RAFT tissue equivalents for the cornea[ J]. Regen Med, 2014, 9(2):
167-177. DOI: 10.2217/rme.13.92.
32、López-Paniagua M, Nieto-Miguel T, de la Mata A, et al. Consecutive
expansion of limbal epithelial stem cells from a single limbal
biopsy[ J]. Curr Eye Res, 2013, 38(5): 537-549. DOI: 10.3109/
02713683.2013.767350.López-Paniagua M, Nieto-Miguel T, de la Mata A, et al. Consecutive
expansion of limbal epithelial stem cells from a single limbal
biopsy[ J]. Curr Eye Res, 2013, 38(5): 537-549. DOI: 10.3109/
02713683.2013.767350.
33、Spaniol K, Witt J, Mertsch S, et al. Generation and characterisation of
decellularised human corneal limbus[ J]. Albrecht Von Graefes Arch
Fur Klin Und Exp Ophthalmol, 2018, 256(3): 547-557. DOI: 10.1007/
s00417-018-3904-1.Spaniol K, Witt J, Mertsch S, et al. Generation and characterisation of
decellularised human corneal limbus[ J]. Albrecht Von Graefes Arch
Fur Klin Und Exp Ophthalmol, 2018, 256(3): 547-557. DOI: 10.1007/
s00417-018-3904-1.
34、Liang Q, Le Q, Cordova DW, et al. Corneal epithelial thickness
measured using anterior segment optical coherence tomography
as a diagnostic parameter for limbal stem cell deficiency[ J]. Am J
Ophthalmol, 2020, 216: 132-139. DOI: 10.1016/j.ajo.2020.04.006.Liang Q, Le Q, Cordova DW, et al. Corneal epithelial thickness
measured using anterior segment optical coherence tomography
as a diagnostic parameter for limbal stem cell deficiency[ J]. Am J
Ophthalmol, 2020, 216: 132-139. DOI: 10.1016/j.ajo.2020.04.006.
35、Thundikandy R, Priya Chidambaranathan G, Radhakrishnan N, et al. In
vivo confocal microscopic evaluation of the limbus and cornea in vogt
koyanagi haradas syndrome[ J]. Ocul Immunol Inflamm, 2022, 30(6):
1361-1368. DOI: 10.1080/09273948.2021.1873395.Thundikandy R, Priya Chidambaranathan G, Radhakrishnan N, et al. In
vivo confocal microscopic evaluation of the limbus and cornea in vogt
koyanagi haradas syndrome[ J]. Ocul Immunol Inflamm, 2022, 30(6):
1361-1368. DOI: 10.1080/09273948.2021.1873395.
36、Han L, Tan B, Hosseinaee Z, et al. Line-scanning SD-OCT for in-vivo,
non-contact, volumetric, cellular resolution imaging of the human
cornea and limbus[ J]. Biomed Opt Express, 2022, 13(7): 4007-4020.
DOI: 10.1364/BOE.465916.Han L, Tan B, Hosseinaee Z, et al. Line-scanning SD-OCT for in-vivo,
non-contact, volumetric, cellular resolution imaging of the human
cornea and limbus[ J]. Biomed Opt Express, 2022, 13(7): 4007-4020.
DOI: 10.1364/BOE.465916.
37、Miri A, Al-Aqaba M, Otri AM, et al. In vivo confocal microscopic
features of normal limbus[ J]. Br J Ophthalmol, 2012, 96(4): 530-536.
DOI: 10.1136/bjophthalmol-2011-300550.Miri A, Al-Aqaba M, Otri AM, et al. In vivo confocal microscopic
features of normal limbus[ J]. Br J Ophthalmol, 2012, 96(4): 530-536.
DOI: 10.1136/bjophthalmol-2011-300550.
38、Pellegrini G, Golisano O, Paterna P, et al. Location and clonal analysis
of stem cells and their differentiated progeny in the human ocular
surface[ J]. J Cell Biol, 1999, 145(4): 769-782. DOI: 10.1083/
jcb.145.4.769.Pellegrini G, Golisano O, Paterna P, et al. Location and clonal analysis
of stem cells and their differentiated progeny in the human ocular
surface[ J]. J Cell Biol, 1999, 145(4): 769-782. DOI: 10.1083/
jcb.145.4.769.
39、Romano AC, Espana EM, Yoo SH, et al. Different cell sizes in human
limbal and central corneal basal epithelia measured by confocal
microscopy and flow cytometry[ J]. Invest Ophthalmol Vis Sci, 2003,
44(12): 5125-5129. DOI: 10.1167/iovs.03-0628.Romano AC, Espana EM, Yoo SH, et al. Different cell sizes in human
limbal and central corneal basal epithelia measured by confocal
microscopy and flow cytometry[ J]. Invest Ophthalmol Vis Sci, 2003,
44(12): 5125-5129. DOI: 10.1167/iovs.03-0628.