
目的:结合医院小儿眼科常见病种调研国内儿童眼用制剂药物临床试验开展现状,为儿童眼用制剂药物临床试验的发展提供参考。方法:基于国家药物临床试验登记与信息公示平台和医院信息系统,结合郑州市第二人民医院儿童眼科病种,分析儿童眼科药物临床试验开展情况。 结果:医院门诊就诊患者以屈光不正最多(占68.49% ),其次是结膜炎(占11.25%),再次是斜视(占8.60%)。平台共检索到相关临床试验165项,儿科专用药物临床试验25项,其中延缓青少年近视方面试验24个,小儿结膜炎试验1个,其他病种药物临床试验检测结果为0;药物临床试验中以I期和Ⅲ期临床试验为主;延缓青少年近视方面试验已完成试验8项,其他都在进行中。结论:儿童眼科疾病的药物治疗尚有巨大的临床需求未满足,直接关系到了儿童健康权益保障与生命安全维护。当前国内儿童眼用制剂研发呈现企业参与度低、创新动力不足的现状,其核心制约因素在于项目少、难度大、涉及更多的伦理问题。建议通过政产学研协同创新,系统性推进儿童眼用制剂的研发进展,切实解决我国儿童眼病治疗用药难的问题,为儿童视觉健康提供有力保障。
· 基于国家药物临床试验登记与信息公示平台提供的数据以及国内外文献,发现我国儿童眼科药物研发存在显著的临床需求与供给失衡现象。儿童眼科药物临床试验短缺的关键原因是项目少、难度大、涉及更多的伦理问题。
· 儿童眼科药物品种及剂型短缺。
· 儿童眼科药物临床试验数量少。
· 本研究提出了儿童眼科药物不足的现状以及解决方法,为今后儿童眼科药物临床试验的发展提供了方向。
随着我国三孩政策的开放,儿童人口总量平稳增长。根据国家统计局2023年年末人口数及其构成调研数据显示0~15岁(含不满16周岁)24 789万人,占总人数的17.6%[1]。随着儿童人口总数的增长,儿童眼科疾病也呈现出多样化的趋势,对儿童眼用制剂的种类需求急剧增加。眼用制剂是指直接用于眼部发挥治疗作用的无菌制剂,主要用于局部治疗,包括散瞳、缩瞳、降低眼压、抗感染等。儿童时期是视觉功能发育的关键时期,近视已成为全球性公共卫生问题,其引发的视力损伤及失明风险正受到广泛关注。最新数据显示,中国近视患者总数已突破4.5亿,其中儿童青少年群体呈现低龄发病、快速进展、程度深等特征[2]。尤为值得警惕的是,高度近视可诱发多种不可逆性致盲病变,已经成为引起视力损害或致盲的第二大疾病[3]。因此,采取有效的干预、治疗手段来延缓近视进展、防止形成高度近视是本病的治疗关键。本研究旨在分析目前常见儿童眼病相关的药物临床试验现状,提出对未来儿童眼用制剂实现多选择性的期许。
|
人数 |
占比/% |
|
|
屈光不正 |
88 494 |
68.49 |
|
结膜炎 |
14 533 |
11.25 |
|
斜视 |
11 105 |
8.60 |
|
弱视 |
7 165 |
5.55 |
|
睑内翻和倒睫 |
1 717 |
1.33 |
|
睑腺炎 |
1 545 |
1.20 |
|
眼挫伤 |
1 069 |
0.83 |
|
角膜上皮损伤 |
706 |
0.55 |
|
眨眼症 |
667 |
0.52 |
|
上睑下垂 |
574 |
0.44 |
|
眼睑肿物 |
503 |
0.39 |
|
睑板腺囊肿 |
428 |
0.33 |
|
干眼症 |
394 |
0.30 |
|
泪囊炎 |
302 |
0.23 |
|
合计 |
129 202 |
100.00 |
|
试验总数 |
小儿试验数量 |
|
|
近视 |
30 |
24 |
|
结膜炎 |
75 |
1 |
|
干眼 |
43 |
0 |
|
泪囊炎 |
16 |
0 |
|
睑腺炎 |
1 |
0 |
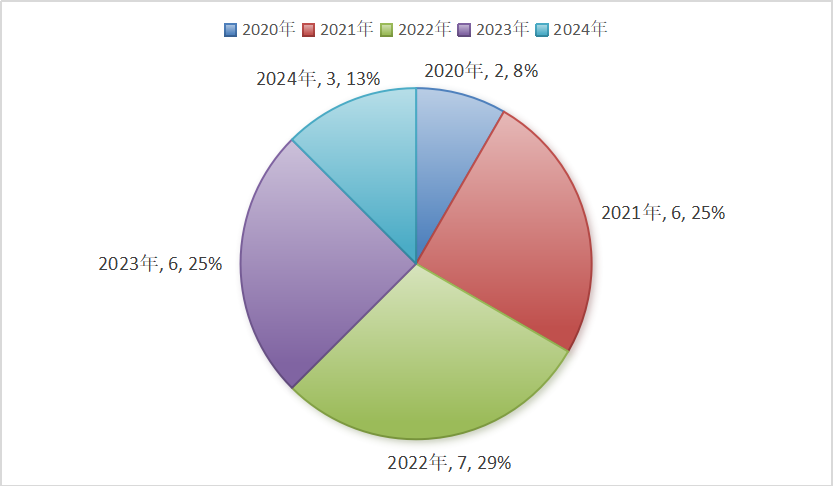
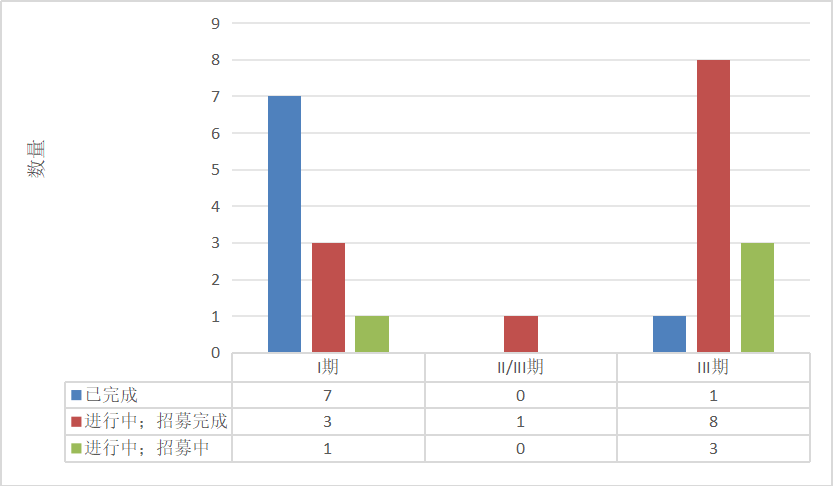
本研究结果显示,屈光不正是我院门诊诊断最多的一种疾病,其中近视的高发率已受到越来越多的关注,亦成为一个亟待解决的问题[4]。视觉功能发育的最关键时期是儿童阶段,如果错过最佳治疗期就可能导致不可逆的视力损伤,早发现是保证有效治疗的关键[5]。近视多起病于儿童时期,近视的发生及发展过程是一个综合多因素共同作用的过程,主要影响因素可以分为遗传因素和环境因素。近视发生、发展的相关机制尚未被完全阐明,影响近视发病率的环境因素多种多样,如过度的学习压力导致过长时间近距离阅读及书写、低光线条件下学习及长时间使用电子产品等[6]。应鼓励减轻儿童学习负担,增加户外活动,将科学用眼纳入全民教育,鼓励近视防控科普宣传进入校园、进入社区。结膜炎的诊断率也较高,研究显示[7],儿童时期急性结膜炎相关病原菌检出的最多年龄段是0~1 岁和 1~3 岁,主要原因可能与该年龄段儿童免疫功能还不完善以及没有养成良好的卫生习惯有关。细菌性结膜炎也好发于儿童群体,尤其以集体生活儿童比如幼托机构为主,可能引起细菌性结膜炎的传播流行,避免流行的关键是早发现早治疗[7] 。居诊断数量第三位的是斜视,斜视是由于中枢管制失调、眼外肌力量失衡,导致双眼不能同时注视目标的一种眼病,通常在儿童期发病,可造成弱视、视功能损害、斜颈等发育不良和心理障碍,该病对患者、家庭乃至社会都会产生消极影响,早诊断、早治疗可避免造成视力和立体视的永久损害[8]。出生体质量、Apgar 评分以及孕龄都是学龄前儿童斜视的关键危险因素,为了避免儿童斜视的危险因素,孕妇需要注意产前的保胎安胎,尽量做到足月分娩[9]。
本研究还显示,儿童药物临床试验短缺。我院常见病种相关药物临床试验数量并不少,但是可用于儿童药物临床试验非常少,儿童药物临床试验几乎都集中在低浓度阿托品项目,这种现状与我国近视人数多有关,也说明该种药物的研发较完善且是目前眼科领域的主要研究方向。近视正迅速成为全球公共卫生问题,其患病率在世界范围内广泛增加,除非采取必要的干预措施,否则到2050年预计将上升至49亿[10]。检索世界卫生组织国际临床试验注册平台关于阿托品延缓儿童青少年近视进展的临床试验相关特征,结果显示70%左右临床试验的注册地点是在中国、印度以及日本,这可能与东亚地区青少年近视人数飙升有关,也标志着我国眼科药物临床试验发展迅速,开展的数量、效率均有稳步增长。2022年,低浓度阿托品滴眼液在儿童青少年近视防控中的应用专家共识[11]和近视管理白皮书[12]都提出了低浓度阿托品在近视防控方面的有效性。Huang等[13]使用荟萃分析的方法对16种近视防控的方法进行了比较,结果表明低浓度阿托品最有效。一项纳入32项研究[14],共涉及样本量5 335例,共计10 670只眼,包括7种不同浓度阿托品对比安慰剂的结果。Meta分析结果显示,与安慰剂相比,0.01%阿托品对等效球镜度变化有显著的影响,能够显著抑制眼轴长度的增长。2024版专家共识强调了0.01%阿托品滴眼液作为延缓近视进展基础浓度的有效性,并探讨了与其他近视防控手段联合应用的优势,给0.01%阿托品滴眼液在临床实践应用提供指导[15]。使用0.01%硫酸阿托品滴眼液有助于控制儿童近视进展,且耐受性良好[16-19]。吴小梅等[20]研究表明0.01% 阿托品滴眼液可有效减缓近视儿童青少年眼轴及近视度数的增长,控制儿童青少年近视进展,且安全性佳。美国眼科学会推荐近视青少年使用0.01%低浓度阿托品,目前报道显示近视防控效果为50%~53%[21]。阿托品作为有效的近视防控药物,已经在新加坡、中国台湾等地区使用,在中国其他地区比如上海、北京、温州、河南等地医院有售阿托品滴眼液院内制剂,有些厂家低浓度阿托品已经上市,各厂家临床试验也在进行中[22]。全世界均在积极关注低浓度阿托品的防控效果、影响因素以及防控机制。低浓度阿托品临床试验的蓬勃发展必将推动低浓度阿托品尽快上市,可以打破行业垄断,使该药品的价格维持在一个正常的水平,为广大近视青少年带来福音。斜视、倒睫、上睑下垂、眼睑肿物等大多需要手术治疗,所以在试验用药方面研究非常少。结膜炎、干眼、泪囊炎以及睑腺炎都是儿童眼科常见高发病,但是明确用于儿童的临床试验却寥寥无几,医生在选择用药的时候面临无药可用的困境,只能参考成人用药。
药品审评中心于2021年4月15日发布了《用于产生真实世界证据的真实世界数据指导原则(试行)》,针对儿科临床试验存在的三大核心难点—研究周期长、受试者招募难、伦理风险高,提出了基于真实世界研究的儿童研发模式。该政策重点聚焦“超说明书用药”规范化难题,通过建立多源医疗数据整合平台,对已获国内外临床指南推荐但缺乏儿童适应症批文的药物,进行回顾性研究或者探索真实世界数据来支持儿童用药研发,构建儿童用药动态证据链。通过选取重点品种开展试点,提供儿童应用的证据,支持说明书适应证的扩展,可以解决临床经验性给药问题,这将有利于降低广大儿童用药安全隐患[23]。目前研究比较热的另一领域,评估临床试验成功可能性或支持决策制定的临床试验模拟( clinical trial simulation, CTS, 又称 in silico trials),因其具有可以减少开发新医疗设备和药物的时间以及成本,并具有减少临床试验对人类以及动物伤害的潜能,有望改变药物研发以及临床试验传统运行模式[24],随着这个领域的不断研究突破有望改变现状。
低浓度阿托品的临床试验集中在2020年以后,试验分期以Ⅰ期和Ⅲ期为主,与国际上新药研发聚焦于Ⅱ期、Ⅳ期为主的情况不同,我国当前的新药研发更多集中在早期研发或者临近上市状态,而国际制药行业则呈现出以研发中期以及上市后研究为主的研发格局[25]。这说明在眼科领域新药的研发非常积极,不断有新药出现,眼科领域正呈现“研发创新—临床转化”双轮驱动的发展态势,最终药物成功上市的概率也将大大提升[26]。如何推动儿童眼用制剂药物临床试验的发展是一个世界性难题,也是一个必须引起重视的问题。思考可采用措施:1)数据支持、政府支持。建立儿童眼科疾病数据库,筛选常见病种,鼓励的同时辅予强制性手段,由国家层面选择有实力的厂家,指导儿童药物临床试验的开展,给予全面的政策支持以及较多的经济鼓励,以促进儿童临床试验的发展,提升企业对于儿童眼用制剂研发的积极性。2)扩展研发模式。引导医药企业开展个体化的新药研发、鼓励应用新技术和新方法,为今后儿童眼科用药提供更多的选择。3)增加研发手段。期待虚拟患者研究取得新的突破,能够更好地用于儿童药物临床试验研究。4)科普宣传。面向社会科普药物临床试验,公示药物临床试验相关数据,明确受试者未被满足的需求,让更多的人了解临床试验并消除恐惧参与其中;(5)完善受试者风险保障。为儿童药物临床试验设立临床试验数据监察委员会(data monitoring committee, DMC)也称为数据和安全监察委员会(data and safety monitoring committee, DSMC)、为受试者购买保险、增加补贴、保障儿童受试者的合法权益。
综上所述,本研究基于临床试验登记平台,系统分析了我国治疗儿童眼部疾病的药物临床试验现状。结果显示可用于儿童的药物临床试验远不能满足儿童总体数量的增长对于此类药物临床试验的需求。本研究存在以下局限性需要说明:首先,受限于数据库登记信息的完整性和数据更新时效,可能遗漏部分尚未完成注册申报的临床试验及研究者发起的临床研究。其次,由于临床试验登记具有一定的滞后性,基于公示日期进行的统计分析可能与实际研究进度存在时间偏差。此外,在适应症分类环节采用人工筛选方式,虽已建立双重核查机制,但仍可能存在人为疏漏或误判的情况。小儿眼科的建设和发展还有很多的困难有待解决,希望在未来能够借助于国家、医疗机构、小儿眼科专家等各方面的力量,共同推进小儿眼科药物研发的均衡发展。


点击右上角菜单,浏览器打开下载