
目的:研究雌二醇(estradiol,E2)和丙酸睾酮(testosterone propionate,TP)对兔泪腺上皮细胞凋亡及对MMP-9蛋白表达的影响,探讨雌二醇及丙酸睾酮对干眼的作用机制。方法:体外培养兔泪腺上皮细胞,分别给予雌二醇及丙酸睾酮处理,双氧水(H2O2)诱导细胞凋亡,流式细胞仪检测细胞凋亡和免疫细胞化学法检测细胞MMP-9蛋白表达。实验分4组:凋亡对照组(AC组)、雌二醇组(E2组)、丙酸睾酮组(TP组)和空白对照组(BC组)。AC组只给予H2O2诱导凋亡,E2组给予1×10-5mol/L雌二醇处理,TP组给予丙酸睾酮处理,BC组未加药物干预及未加H2O2诱导凋亡。结果:经H2O2诱导细胞凋亡后,泪腺上皮细胞早期凋亡率和MMP-9蛋白表达累积光密度值与BC组相比,AC组、E2组及TP组均显著增加;同比AC组,E2组及TP组细胞凋亡率和MMP-9蛋白表达量降低;E2组凋亡率及蛋白表达量比TP组明显降低;其差异均具有统计学意义(P<0.01)。结论:雌二醇和丙酸睾酮对H2O2诱导兔泪腺上皮细胞凋亡有一定的抑制作用,同时泪腺上皮细胞中MMP-9表达含量也降低,提示雌二醇和丙酸睾酮抑制兔泪腺上皮细胞凋亡的作用机制可能与MMP-9有关。
干眼症在人群中发病率与年龄呈正相关,随年龄的增长而增加,且女性更常见,尤以绝经后妇女明显。进入更年期后,人体内的雌激素和雄激素的水平都会有明显的改变,而这与临床上统计的干眼发病年龄呈正相关[1]。性激素在干眼发病中起重要作用,但具体作用机制目前尚不清楚。现已有实验[2-3]证明性激素对维持泪腺组织的正常功能、形态和生理生化起重要作用,它的减少可以促进泪腺细胞的凋亡、坏死和淋巴细胞浸润等病理改变。基质金属蛋白酶(matrix metalloproteinases,MMPs),尤其是MMP-9的异常表达可直接导致多种细胞如神经元细胞的凋亡[4],MMP-9与细胞凋亡的相关性在其他疾病方面有较多研究,但在干眼疾病中研究较少见。本实验通过研究雌激素及雄激素对兔泪腺上皮细胞凋亡的影响,同时观察细胞中MMP-9蛋白表达的改变,探讨性激素影响泪腺细胞的凋亡作用及其机制。
普通级新西兰白兔购自广东省医学实验动物中心,重2~2.5 kg,月龄2~3个月,雄性,无眼病。DMEM/F12培养基、胎牛血清和胰蛋白酶溶液均购自美国Hyclone公司,鼠抗单克隆抗体Cytokeratin(Pan)(产品编号:MAB-0049)、鼠抗人MMP-9单克隆抗体(编号MAB-0245)、超敏广谱S-P试剂盒购自Maxin公司,雌二醇(产品批号E8875)均购自美国Sigma公司,丙酸睾酮购自上海通用药业有限公司,DAB显色剂试剂盒购自武汉博士德生物工程有限公司,二甲基亚砜(DMSO)、Vnnex inV-FITC凋亡试剂盒购自德国Bender公司。
1.2.1 兔泪腺细胞原代培养及鉴定
常规无菌取兔泪腺,将泪腺置于庆大霉素:生理盐水(1:1)溶液浸泡10 min,无菌超净台内无菌PBS冲洗泪腺,剪碎,加入等量0.25%胰蛋白酶和0.06%EDTA,于37 ℃恒温水浴箱消化20 min,培养液终止细胞消化,吹打细胞及组织块,离心,弃上清,加入含10%胎牛血清培养液制成细胞悬液,转至培养瓶,于细胞培养箱中培养,24 h后首次半量换液,后每2~3天换液1次。细胞鉴定选用鼠抗单克隆抗体Cytokeratin(Pan)。
1.2.2 流式细胞仪检测细胞凋亡
取2,3,4代细胞用于实验,实验分为1×10−5mol/L浓度雌二醇干预组(E2组),1×10−5mol/L浓度丙酸睾酮干预组(TP组),未加药物干预及未诱导凋亡的空白对照组(BC组),未加药物干预但有诱导凋亡的凋亡对照组(AC组)。待细胞培养至预定时间,消化、收集细胞,配制成1×105个/mL细胞悬液,分别培养于小培养瓶内,3 d后换上无血清培养基,加入终浓度为1×10−5mol/L的雌二醇及丙酸睾酮,同时设空白对照组和凋亡对照组,继续培养24 h,加入终浓度1×10−4mol/L H2O2培养1 h诱导细胞凋亡,消化收集细胞,每个样品取5×104个细胞用于实验,实验按Annexin V-FITC试剂盒说明书操作。同时设1管阴性对照(样品内不加Annexin V-FITC及PI)。
1.2.3 细胞免疫化学法
取2,3,4代泪腺细胞,按约5×105个/mL接种至备置载玻片的6孔板内,培养3~4 d后,待细胞长满玻片,换上无血清培养基,分别加入终浓度为1×10−5mol/L的雌二醇及丙酸睾酮,继续培养24 h,同时以未加药物干预的无血清培养基培养同期接种的泪腺细胞设为空白对照组和凋亡对照组。24 h后,雌二醇组(E2组)、丙酸睾酮组(TP组)及未加药物的凋亡对照组内(AC组)再分别加入终浓度为1×10−4mol/L的H2O2继续培养1 h。细胞培养至预定时间后,吸去培养基,加入PBS浸泡1 min,重复3次,室温下用4%多聚甲醛固定60 min,PBS冲洗1 min,重复3次,0.1%Triton-100处理10 min,PBS冲洗,过氧化酶阻断剂室温湿盒孵育10 min以阻断内源性过氧化酶活性,PBS冲洗,正常非免疫山羊血清室温封闭10 min,不洗,滤纸吸去多余血清,加入鼠抗人MMP-9单克隆抗体,并设阴性对照,放4 ℃湿盒放12 h,室温复温2 h,PBS冲洗,然后加生物素标志物二抗于室温孵育1 h,PBS冲洗,加入链霉菌抗生物素-过氧化物酶溶液孵育1 h,DAB显色,Mayer’s苏木精复染30 s,梯度酒精脱水,二甲苯透明,中性树胶封固。
1.2.4 结果观察及判定
光学显微镜下观察、拍摄,MMP-9阳性表达呈棕黄色或棕褐色,主要表达细胞浆和细胞膜上,采用Image Pro Plus 6.0图像分析软件检测细胞阳性染色的累积光密度值。
采用SPSS 16.0统计软件进行分析。数据以均数±标准差(X̄±s)表示,用单因素方差分析,两两比较用LSD-t 检验,多组间比较用S-N-K检验,以P<0.05为差异有统计学意义。
2.1 兔泪腺细胞培养及鉴定
正常泪腺细胞呈不规则多边形,核圆而透亮(图1A)。Cytokeratin(pan)抗体阳性表达于细胞浆内呈棕黄色颗粒(图1B)。
流式细胞仪Annexin V-FITC/PI双染法检测泪腺细胞凋亡,检测结果见表1,与空白对照组相比,加入1×10−4mol/L H2O2诱导后泪腺细胞的早期凋亡率均增加,差异有统计学意义(P<0.01);与单纯加入H2O2诱导的凋亡对照组相比,预先加入1×10−5mol/L雌二醇或丙酸睾酮干预的细胞,其早期凋亡率明显较低(P<0.01);同时1×10−5mol/L丙酸睾酮干预后的细胞凋亡率较同等浓度雌二醇干预后的高(P<0.01;表1,图2A-2D)。
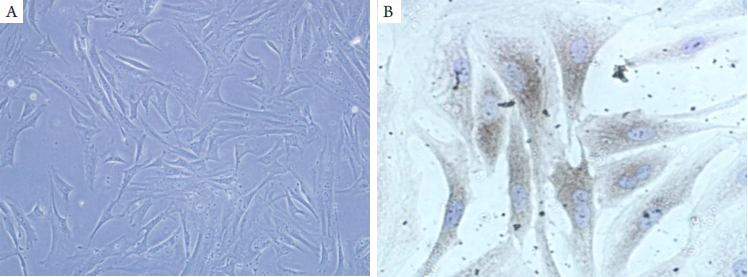
图1 兔泪腺细胞鉴定
Figure 1 Identification of rabbit lacrimal gland cells
(A)兔泪腺上皮细胞(×200) ;(B)兔泪腺细胞Cytokeratin(pan)抗体阳性(DAB显色,×400)。
(A) Rabbit lacrimal gland cells (×200); (B) Positive staining of cytokeratin antibody in rabbit lacrimal gland cells (DAB colored, ×400).
表1 雌二醇及丙酸睾酮对泪腺上皮细胞早期凋亡的影响
Table 1 Effects of E2 and TP on early apoptosis in lacrimal gland epithelial cells
|
组别 |
干预 |
早期凋亡率(%) |
|
AC组 |
H2O2 |
13.12 ±0.73* |
|
E2组 |
1×10−5 mol/L E2 + H2O2 |
6.79±0.53*&# |
|
TP组 |
1×10−5mol/L TP + H2O2 |
11.14±0.53*& |
|
BC组 |
Control |
5.17 ±0.07 |
与BC组相比,*P<0.01;与AC组相比,&P<0.01,与TP组相比,#P<0.01。
Compared with the BC group, *P<0.01; Compared with the AC group, &P<0.01, Compared with the TP group, #P<0.01.
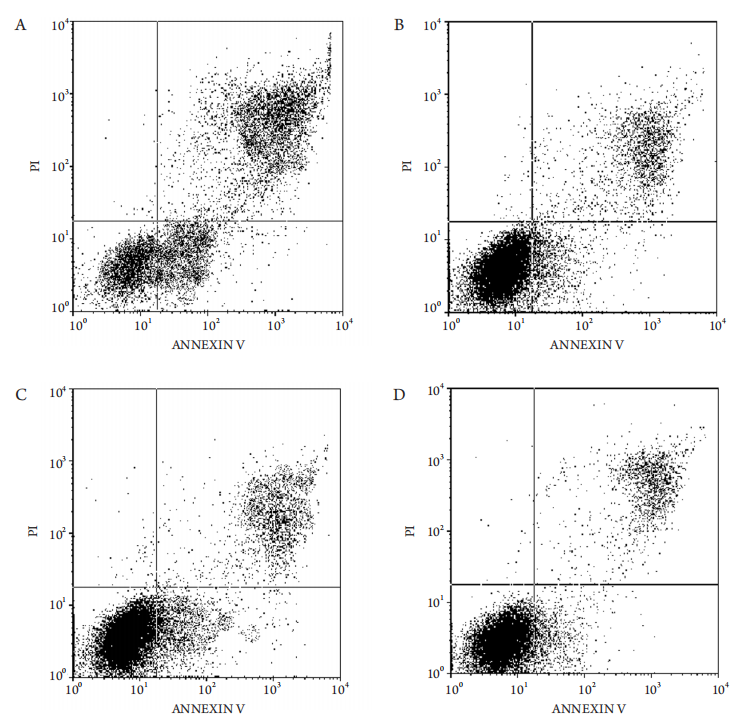
图2 流式细胞凋亡图
Figure 2 Flow cytometry
(A) AC组流式细胞凋亡图;(B) E2组流式细胞凋亡图;(C) TP组流式细胞凋亡图;(D) BC组流式细胞凋亡图。
(A) Flow cytometry in AC group; (B) Flow cytometry in E2 group; (C) Flow cytometry in TP group; (D) Flow cytometry in BC group.
MMP-9主要表达于泪腺细胞的胞浆与胞膜上,在经1×10−4mol/L H2O2诱导凋亡后,细胞中MMP-9的表达明显高于未经任何处理的空白对照组(P<0.01),同时给予1×10−5mol/L雌二醇和丙酸睾酮干预,其MMP-9表达量明显降低,差异有统计学意义(P<0.01),其中以雌二醇干预组降低明显(表2,图3A-3D)。
表2 雌二醇及丙酸睾酮对泪腺细胞MMP-9蛋白表达的影响
Table 2 Impact of E2 and TP on MMP-9 expression in lacrimal gland cells
|
组别 |
干预 |
累积光密度值 |
|
AC |
H2O2 |
167 651.0 ±01 067.6* |
|
E2 |
1×10−5mol/L E2+ H2O2 |
76 317.0±0 954.4*&# |
|
TP |
1×10−5mol/L TP+ H2O2 |
109 451.0±01 025.0*& |
|
BC |
Control |
39 901.0 ±01 694.6 |
与BC组相比,*P<0.01;与AC组相比,&P<0.01,与TP组相比,#P<0.01。
Compared with the BC group, *P<0.01; Compared with the AC group, &P<0.01; Compared with the TP group, #P<0.01.

图3 不同组MMP-9蛋白表达
Figure 3 Expression of MMP-9 in different groups
(A)凋亡对照组MMP-9蛋白表达(DAB显色,×200) ;(B)雌二醇干预组MMP-9表达(DAB显色,×200) ;(C)丙酸睾酮干预组 MMP-9蛋白表达(DAB显色,×200) ;(D)空白对照组MMP-9蛋白表达(DAB显色,×200)。
(A) MMP-9 expression in group AC (DAB colored, ×200); (B) MMP-9 expression in group E2 (DAB colored, ×200); (C) MMP-9 expression in group TP (DAB colored, ×200); (D) MMP-9 expression in group BC (DAB colored, ×200).
MMPs是一组锌离子依赖性金属蛋白内肽酶超家族,在生理环境下,并在有内在Zn2+和外在Ca2+条件下发挥酶活性,它可以降解基底膜及绝大部分细胞外基质(extracellular matrix,ECM)成分,如胶原蛋白、层粘连蛋白、纤维粘连蛋白、弹性蛋白及蛋白聚糖类蛋白等[5]。在生理环境下,MMPs参与胚胎的发育、正常组织的重塑、创伤的愈合和血管发生等;在病理条件下,参与纤维变性、炎症改变及肿瘤生长、迁移、侵袭和转移等[6]。正常情况下,MMPs与其组织金属蛋白酶抑制剂(tissue inhibitor of metalloproteinase,TIMPs)保持着相对平衡,故而MMPs的表达水平较低。目前已发现MMPs至少有26个成员,主要由上皮细胞、成纤维细胞、中性粒细胞、内皮细胞、间质细胞、单核巨噬细胞和肿瘤细胞等合成与分泌,在基体的许多重要部位都有表达。研究较多的MMP-9与MMP-2均为明胶原,能降解明胶及IV,V,VII,IX和X型胶原,是MMPs家族中重要明胶酶。
研究[7]发现干眼症患者中的MMP9活性明显增高,干眼症及干燥环境下都会刺激眼表上皮细胞分泌MMP-9和其MMPs,MMP-9可分解眼表上皮细胞的膜蛋白,从而影响角膜上皮屏障功能[8-10]。研究[8]发现MMP-9敲除鼠中发生角膜上皮疾病降低,干眼症状得以改善。Leonard等[11]发现在各种眼表疾病中人泪液的MMP-9增加,如无菌性角膜溃疡。在一组干眼患者中,有研究[12]发现MMP-9的活性水平随着眼表疾病的严重程度进展而增加,同时MMP-9活性水平与角膜荧光染色分数和低对比视敏度相关。以往研究[13]证明眼部其他上皮组织中也可合成MMPs ,如角膜上皮细胞合成MMP-2/MMP-9,视网膜上皮细胞合成MMPs[14],角膜移植术后MMP-9和MMP-8的表达明显增高[15]。Zylberberg等[16]用免疫细胞化学法证实兔泪腺细胞可以分泌MMP-2/MMP-9蛋白。
前期研究[17]表明不同浓度雌二醇及丙酸睾酮对H2O2诱导的兔泪腺上皮细胞凋亡具有一定的抑制作用。本实验进一步通过用免疫细胞化学法检测1×10−5mol/L雌二醇及1×10−5mol/L丙酸睾酮对H2O2诱导兔泪腺细胞凋亡后MMP-9蛋白表达的影响,结果表明:MMP-9在雌二醇及丙酸睾酮干预组中表达含量较凋亡对照组低,但比空白对照组高,提示雌二醇和丙酸睾酮对H2O2诱导兔泪腺上皮细胞凋亡后MMP-9的表达有一定的抑制作用。综合实验发现:雌二醇和丙酸睾酮在抑制H2O2诱导的兔泪腺细胞凋亡的同时伴有MMP-9表达含量的降低,故猜想雌二醇及丙酸睾酮对泪腺上皮细胞凋亡抑制作用的机制可能与MMP-9有关。
研究表明MMP-9与细胞凋亡关系密切,Gu等[18]报道MMP-9能诱导神经元发生凋亡,而MMP-9抑制剂能阻断这一过程,S -亚硝基化能激活MMP-9并诱导神经细胞的凋亡。MMPs对细胞凋亡的作用机制尚不十分明确。性激素对泪腺上皮细胞凋亡的抑制作用,很可能就是通过抑制MMP-9的表达,从而抑制细胞凋亡,但具体作用机制还有待进一步深入研究。


点击右上角菜单,浏览器打开下载