
Adams[1]首次对黄斑中的卵黄状变化进行了描述,他于1883年发表了一份描述“特殊黄斑变化”的病例报告。在1905年,Best[2]首次描述了一种在家族中发现并影响8名成员的类似情况。然而,直到1950年代早期,Zanen和Rausin在其出版的“黄斑先天性卵黄囊肿”一文中[3],才首次引入“卵黄样”这一术语(拉丁词vitellum, 意为蛋黄)。近年来越来越多的研究显示,卵黄样病变并非仅限于Best病,多种其他疾病也可以在后极部出现类似的浅黄色光感受器脱离。这些疾病包括家族性遗传性疾病、视锥-视杆细胞营养不良、玻璃体视网膜牵引、视网膜色素上皮(retinal pigment epithelium, RPE)病变,以及肿瘤旁综合征。
然而还有一类卵黄样物质沉积伴脱离的视网膜疾病,即急性渗出性多形性卵黄样黄斑病变(acute exudative polymorphous vitelliform maculopathy, AEPVM)临床较为罕见,1988年由Gass等[4]首次在2例患者中描述。迄今为止全球的文献报告中仅有20余例病例报道,其中包含了与不同肿瘤相关的其他病例。本文针对AEPVM变的临床表现、影像学特征、诊断及鉴别诊断、发病机制及治疗相关研究进展进行综述。
该疾病的特征是急性起病,双眼轻中度视力丧失或伴有视物变形、畏光等症状,双侧眼底可见多个位于RPE层的黄白色、多形性浆液性视网膜脱离病灶,形态可随时间发生改变,沿视网膜血管弓分布的小水泡样病变以“蜂窝状”模式发展[5],随着时间的推移,可以看到黄白色物质在浆液性脱离区内积聚,呈现浆液黄色外观。脱离中的浆液成分在恢复阶段首先消退,仅留下淡黄色的视网膜下沉积物。这些沉积物会持续数月至数年。黄色卵黄样物质完全分解所需的时间根据累积量的不同而有很大差异。以浆液性脱离为主的患者可能会在短短几个月内完全康复,而卵黄状间隙中有大量黄白色物质的患者即使在临床症状及视力改善后,数年内仍有残留。电生理学发现在一些患者中,硬化或凝固的黄色渗出物在整个后极持续呈多灶性分布,它们可能会在多年后被重新吸收,但会在RPE中残留变化。
在大数情况下,AEPVM发病时是一种双侧对称性疾病,然而在后期,视网膜下液逐渐消失以及视网膜下沉积物开始重新吸收后,可以观察到双眼不对称性恢复[6]。
在一项回顾性研究分析中[7],收集了18例AEPVM患者,有4例通过全外显子基因检测进行了BEST1变异的筛查,3例患者进行了peripherin/RDS突变的筛查,未发现与疾病相关的变异。最初作为研究的一部分进行评估但随后被排除的3例患者,在基因检测显示BEST1中有双等位基因突变后,被诊断为常染色体隐性BEST病[8]。值得注意的是这3例患者均为儿童或青少年,强调了在青少年组发生病变的患者进行基因检测的必要性。
同样在上述的回顾性分析系列中[7],18例患者中有12例患者进行随访检查。记录从穹窿状视网膜下液首次出现到再吸收的时间。随访时间差异很大,从1周到30个月(均值为11.1个月)。浆液性脱离的持续时间介于2~5个月。观察到在10例具有穹隆状视网膜下液的患者中,有7例患者的液体完全吸收,黄白色沉积物的吸收可能需要更长的时间,甚至数年,并且在大多数患者中(15例中的12例)没有观察到完全吸收,也可能是因为大多数患者缺乏后续随访。18例患者确诊时视力为20/20到20/100(平均值为20/40),在随访期间改善或保持稳定在20/20到20/100(平均值为20/30)。
与Best病一样,AEPVM病程多变,病程中可能表现新的并发症,如脉络膜新生血管、视网膜褶皱、脉络膜厚度增加等,继发性脉络膜新生血管 (choroidal neovascularization, CNV) 可使 AEPVM 的病程复杂化。有病例报告显示一例 34 岁患者在出现症状并确诊AEPVP两年后继发 CNV,玻璃体内单次注射曲安奈德治疗后,CNV 完全消退,然而,在注射后30个月仍可观察到持续的黄色视网膜下沉积物[9]。 AEPVM 的另一个特征是复发。有不少病例报告[10-12]显示患者在之前的临床症状完全缓解后数月至数年后再次发作,症状与 AEPVM 一致。
1.4.1 眼底荧光血管造影
眼底荧光素血管造影(fundus fluorescein angiography, FFA)通常不会观察到病变区域的荧光素渗漏。视神经和视网膜血管未发现通透性增加的迹象。有趣的是,频域OCT(optical coherence tomography, OCT)上看到的视网膜下液及视网膜层间的囊样改变不会出现在FFA上,类似于遗传性视网膜疾病中看到的荧光素阴性黄斑囊样变性(图 1)。
1.4.2 吲哚菁绿血管造影
与FFA一样,吲哚菁绿血管造影(indocyanine green angiography, ICGA)可能无法在 AEPVM 的最早阶段检测到眼底变化,或者只能微弱地显示病灶。然而,在具有蜂窝状沉积物的患者中,晚期 ICGA可显示出多个小泡状强荧光病灶,这些小泡状强荧光病灶与检眼镜下看到的病变相关,有时甚至超过了检眼镜下可见的数量。尽管在疾病早期,强荧光与浆液相关,但在后期由于浆液和卵黄状沉积物依次消退,在疾病晚期,多形性视网膜下物质本身在中后期 ICGA 图像上表现为强荧光斑块[13](图 1)。
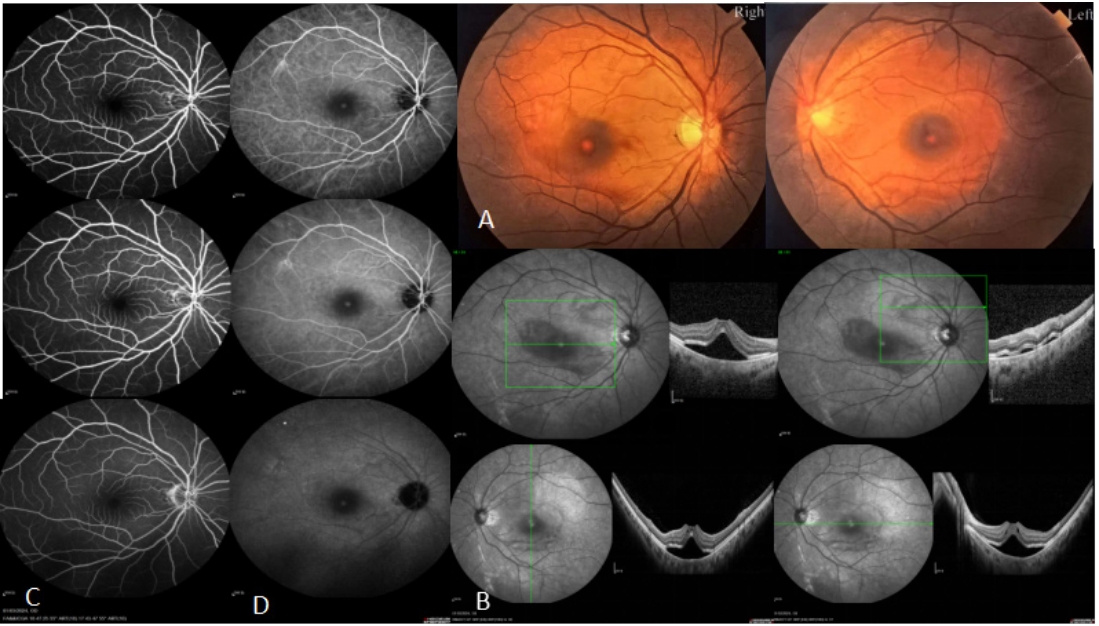
1.4.3 眼底自发荧光
AEPVM早期阶段的浆液不具有自发荧光。一旦视网膜下黄白色物质开始积累,眼底自发荧光(fundus autofluorescence, FAF)成像就会显示出多相沉积物特有的明亮增强的自发荧光。这种物质经常在卵黄空间内沉淀,结合重力作用,沿着浆液脱离的下边缘形成半月板或曲线沉积物[14]。在所谓的“假性积脓”阶段,可以观察到小的点状或斑块状的高自发荧光沿着视网膜外层的脱离区域以及多形性沉积区分布。随后,随着沉积物的消退,强烈的高自发荧光减弱,FAF成像恢复正常[15]。一般来说,自发荧光的程度与卵黄样物质的量相对应,卵黄样物质对血管造影中的脉络膜荧光有掩蔽作用。因此,荧光素血管造影中显示的弱荧光和自发荧光中显示的强荧光构成了这种疾病的反转图像[16]。
1.4.4 光学相干断层扫描
OCT显示AEPVM的浆液性视网膜脱离在黄斑中央时呈大的圆顶状,而在血管弓沿线时呈多个小泡状,与临床上蜂窝状外观相对应[15]。无论浆液脱离的位置如何,OCT 都会显示出一层非常厚的无定形物质积聚在浆液性脱离外层视网膜表面,随着时间的推移,这些物质从外层视网膜表面脱落,并逐渐沉积向脱离的下方区域。这种物质似乎与临床上观察到的黄色视网膜下沉积物相对应,这些沉积物似乎在逐渐消退的浆液性脱离中沉淀[17]。这种多形性黄白色物质的引力下沉是AEPVM最有趣的特征之一,尽管在较小的病灶区域,视网膜下液体的再吸收可能会先于任何显著的迁移。该疾病的后期阶段以视网膜下液体的消退以及视网膜和视网膜色素上皮的重新贴合为特征,从视网膜色素上皮延伸至椭圆区残留一些剩余的黄白色物质,但是残留物质很少突破外界膜[18]。最后,经过数月到数年的时间,患者显示出液体的消退,症状缓解。
由于椭圆体带的完整保存或重新排列,可以解释大多数患者能恢复良好的中央视觉功能。如前所述,“无定形”物质的积累并不限于暴露的视网膜外表面穹顶状浆液性脱离,在疾病的急性早期阶段,浆液性隆起附近的区域可以观察到明显的椭圆体增厚。进一步的研究必须确定这些增厚的层次是否仅是视网膜下液重吸收的结果,或者这种物质的积累是否代表视网膜层分离之前的细胞功能障碍。
使用脉络膜增强模式对单个患者进行频域 OCT 脉络膜厚度测量,发现脉络膜厚度在疾病初始阶段增加,病变部位位于中心凹下和邻近视网膜脱离下方超过300 mm[7]。
1.4.5 近红外、红外和无赤光成像
近红外反射成像 (820 nm) 通常是在 ICGA 之前或与 OCT 一起使用谱域设备采集的。 AEPVM 中浆液性脱离的近红外图像的特征是等荧光中心被低荧光环包围,描绘了 OCT上看到的视网膜下液引起的抬高[15]。这样可以轻松检测到间接检眼镜或其他成像方法遗漏的非常小的病变。沉淀物质可能会表现出略微增强的荧光,但对比度不如 FAF成像。
1.4.6 视觉电生理检查
临床眼电图(electro-oculogram, EOG),是一种在暗适应和明适应条件下,记录外层视网膜和RPE功能状态的电生理检测方法,它检测的是眼的静息电位变化。EOG反映视网膜色素上皮-光感受器复合体的功能,体现弥散性视网膜色素上皮疾病和视网膜光感受器层的疾病。
视网膜电流图 (electroretinogram,ERG)是一种用于评估整个视网膜功能的电生理检测技术。它通过记录视网膜在光刺激下的电活动,反映视网膜的总体功能状态。ERG主要分为全视野ERG(full-field ERG)和多焦ERG(mfERG)。ERG适用于评估广泛的视网膜疾病,如视网膜色素变性、视网膜脱离、视网膜血管炎等。它能够提供视网膜整体功能的评估,帮助诊断和监测疾病的进展。多焦视网膜电流图(multifocal electroretinogram, mfERG)主要用于评估黄斑、周边视网膜等局部区域的功能。它能够精确定位视网膜损伤,适用于黄斑病变、糖尿病视网膜病变、视网膜血管病变等疾病的诊断和监测。
在一项回顾性研究分析中,9例患者的EOG影像被记录,其中4例患者显示异常,2例(50%)在随访检查时完全恢复[7]。进行了ERG检查,结果在2例患者中显示正常。1例患者在mfERG报告有轻微异常发现。
AEPVM的诊断主要依据病史及特征性的眼底表现、多模式影像学检查。基于AEPVM所表现出的黄白色卵黄样病灶,该病需要与成人型卵黄样黄斑营养不良、常染色体隐性Best病(autosomal recessive Best disease, ARB)及Best卵黄样黄斑营养不良等BEST1基因突变型疾病相鉴别。其中,ARB临床表现与AEPVM最为相似。ARB是常染色体隐性遗传病,BEST1基因的双突变引起,包括纯合突变或复合杂合突变,眼底可见双眼后极部至视网膜血管弓附近多灶性视网膜下淡黄色沉积物,OCT表现为与眼底黄白色沉积物对应处视网膜下RPE层的强反射,同样伴随视网膜下积液及视网膜层间囊样水肿,但光感受器外节的强反射光带欠均匀,并且随着卵黄样物质蓄积,可出现强烈的高自发荧光改变。两者鉴别还可以通过电生理检查及基因检测,电生理异常是ARB的特征性表现,该病眼电图常出现Arden比值明显下降,多伴有全视野视网膜电图视杆和(或)视锥细胞振幅降低或峰时延迟,并且随年龄增加,电生理异常可逐渐加重。但是ARB由于遗传异质性导致临床表现的高度异质性,临床明确诊断非常困难,基因检测BEST1基因双突变是确诊ARB金标准[19-20]。此外,由于AEPVM可为特发性或肿瘤性,除了排查全身相关检查进行鉴别之外,两者在临床表现上也存在一定差异。特发性AEPVM多表现为双侧浆液性视网膜脱离,有卵黄样沉积物或泡状病变,病变可以在几个月内自行消退,而副肿瘤性AEPVM患者可有癌症病史,尤其是黑色素瘤或丝裂原活化蛋白激酶信号通路抑制剂(itogen-activated protein kinases inhibitor, MAPK inhibitor)使用史,且多为单侧发病[21],详细区别可见表1。
|
特征 |
IAEPVM |
ARB |
MAR |
|
症状 |
轻度视力下降 |
视力下降 |
视力下降 |
|
家族史 |
无 |
常染色体隐性遗传 |
肿瘤病史 |
|
病变 |
多形性卵黄样,形态随时间改变 |
后极到赤道淡黄色沉积物 |
类圆形视网膜隆起,无黄色物质 |
|
AF |
在浆液性病变内增加,然后随着卵黄物质被吸收而减少 |
随着卵黄状物质的积累,强自发荧光 |
|
|
OCT |
视网膜下液、黄斑囊样改变 |
视网膜下液、黄斑囊样改变 |
|
|
FFA |
无明显异常荧光 |
无明显异常荧光 |
|
|
EOG |
50% 患者Arden比降低 |
Arden比降低 |
|
|
基因检测 |
没有已知的遗传关联或突变 BEST1 |
BEST1基因双突变 |
|
|
临床历程 |
双侧病变外观和进展对称,回归可能是不对称的 |
双边 |
多形性表现可能是单侧的,也可能发生在对侧眼 |
|
炎症或细胞浸润 |
无 |
无 |
浸润性病变(例如淋巴瘤)可能会释放玻璃体细胞 |
|
并发症 |
脉络膜新生血管 |
远视、亚急性闭角型青光眼 |
|
目前AEPVM发病机制尚不清楚。有病例报告部分患者合并有HIV、梅毒感染、莱姆病,或眼部症状出现前有上呼吸道感染病史,尤其是新冠病毒流行之后[22-23],亦有病例报告感染新冠病毒或者接受新冠病毒疫苗之后出现AEPVM症状[24],因此有学者认为,本病的发生可能与全身感染因素相关。另外,有研究者发现在活跃期的 AEPVM 患者血清中检测到了一种抗RPE的抗体:过氧化物酶(peroxidases X3, PRDX3)表达上调,而在静止期和恢复期的该病患者身上表达正常,PRDX3 是一种线粒体蛋白属于过氧化物酶家族的成员,对保护细胞免受氧化损伤十分重要,因此认为该病可能是免疫自身反应造成 PRDX3 表达升高所致[25]。也有学者认为目前所报道的病例中,部分患者罹患乳腺肿瘤、皮肤肿瘤、呼吸道肿瘤等,因此该病可能为一种副肿瘤综合征[26]。
AEPVM 的发病机制与其临床表现密切相关[27],由于各种原因导致 RPE 细胞损伤是AEPVM发病机制的核心因素,出现RPE相应功能障碍。一方面RPE 损伤后,其吞噬光感受器外节盘膜的功能受损,导致大量脱落的外节盘膜在椭圆体带附近沉积,而表现出 OCT中椭圆体带增厚的特征性表现;其次,RPE损伤造成大量脂褐质代谢异常,从而表现出后极部卵黄样物质沉积,自发荧光呈现典型的点片状高自发荧光;另外,由于RPE泵功能被破坏,黄斑区无法完成正常的水分代谢,从而引发了黄斑水肿、神经上皮脱离及视网膜层间液体积存,但是相应区域的血管功能正常,因此在荧光素造影中,此处的黄斑水肿和脱离并渗漏表现。在多模式眼底影像成像的方法中,FAF成像仍然是 AEPVM 的关键诊断之一。FAF的强度被认为与脂褐质的数量和分布成正比。[14]我们观察到的AEPVM患者出现的高自发荧光是支持脂褐质积累的概念。然而,最近有学者提出,卵黄样黄斑病变和中心性浆液性视网膜病中的自发荧光物质源自被吞噬的光感受器外节的不可消化成分,并且自发荧光物质可能在被 RPE吞噬之前积聚在视网膜外层[28-30]。这种物质被认为是由脱落的光感受器外节聚集体组成,其中含有双视黄醇 N-亚视黄基-N-视黄乙醇胺和脂褐素的各种前体,可能部分由于视网膜与 RPE 缺乏处置而积累[16]。AEPVM 中很可能存在类似的机制。尽管急性期的浆液脱离仅具有轻微的自发荧光,但我们发现自发荧光的增加与重力、卵黄色物质的积累平行。目前尚不完全清楚自发荧光的增加是否确实是增加的脂褐素或其前体,或者它是否只是将高自发荧光物质集中在较小区域的结果。在卵黄样黄斑营养不良中,脂褐素通常会掩盖 FFA期间的脉络膜循环,在 AEPVM 中,视网膜下物质的沉积对脉络膜有不同的遮蔽。得注意的是,部分患者在疾病急性期几乎没有表现出 FFA 遮蔽,随着1年后视网膜下腔假性积脓的形成,才逐渐出现遮蔽,同一患者的眼底FAF显示高自发荧光随着卵黄样物质的沉积而增强。显然,这些观察结果提示病程早期视网膜下腔的化学成分与后期阶段不同。可以想象,最初因为RPE功能受损而产生的漏出液,随后因光感受器外节脱落而富含脂褐质和 A2E 前体。因此有研究者假设最初的炎症导致脉络膜毛细血管的通透性增加,从而继发性 RPE 功能障碍和脂褐素的短暂积累。
关于APEVM的治疗,目前并未形成统一方案。多模式影像随访观察后病灶可自行消退[31]。文献中报道的大多数患者无需医疗干预可自行康复。有学者认为早期给予糖皮质激素治疗可减轻黄斑区囊样水肿[32],也有学者持完全相反的意见,认为糖皮质激素可能对AEPVM治疗无效[33],最近的一份报告评估了玻璃体内糖皮质激素植入的无效性[34]。
由于病例报告中所有诊断为 AEPVM 的患者最终都恢复了正常或接近正常的视力,因此以前认为这种疾病不会对 RPE 造成重大损害。然而,随着观察时间的延长,该病可能会反复发作或呈慢性病程,最终导致长期视功能的损害,有些病例显示尽管患者视力已恢复,但 EOG及mfERG异常无法完全改善,这一事实进一步支持了这一点[14]。
总而言之,AEPVM是一种来源不明的罕见视网膜疾病,目前发病机制尚不明确,但该病有特征性的临床表现,且大多数患者视力预后良好。然而,尽管与BEST病有明显不同,AEPVM病程也可能是反复发作或呈慢性过程,表现出相当不对称的症状,并且可能会伴随CNV等并发症。在确诊AEPVM时,应仔细排除其他潜在的伪装疾病,特别是肿瘤相关综合征。 FAF及OCT等多模态成像技术在AEPVM的诊断和治疗监测中发挥重要作用,有助于评估治疗效果和疾病进展 。
本文适用于知识共享许可协议(Creative Commons),允许第三方用户按照署名(BY)-非商业性使用(NC)-禁止演绎(ND)(CC BY-NC-ND)的方式共享,即允许第三方对本刊发表的文章进行复制、发行、展览、表演、放映、广播或通过信息网络向公众传播,但在这些过程中必须保留作者署名、仅限于非商业性目的、不得进行演绎创作。


点击右上角菜单,浏览器打开下载