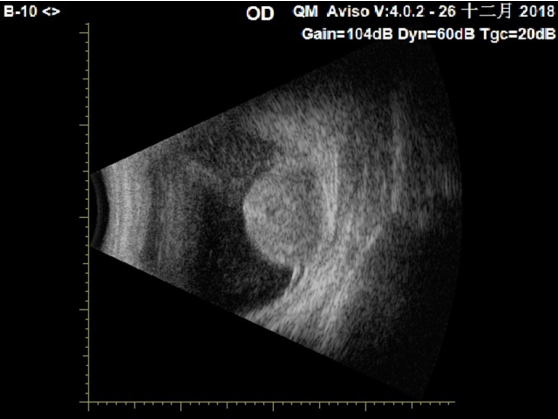
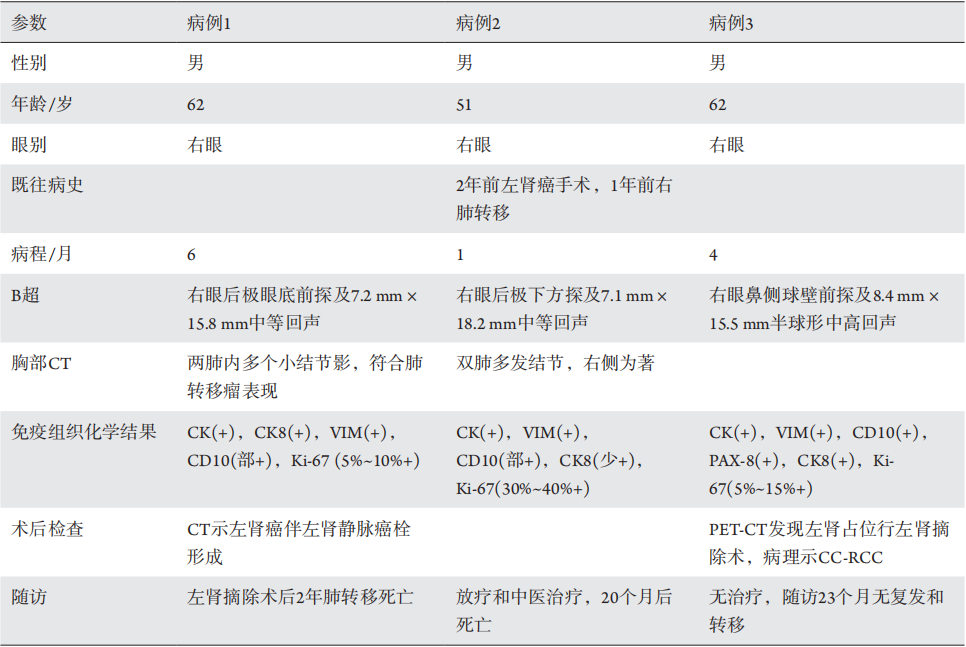
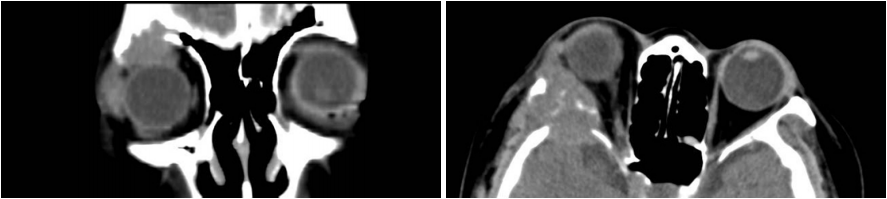
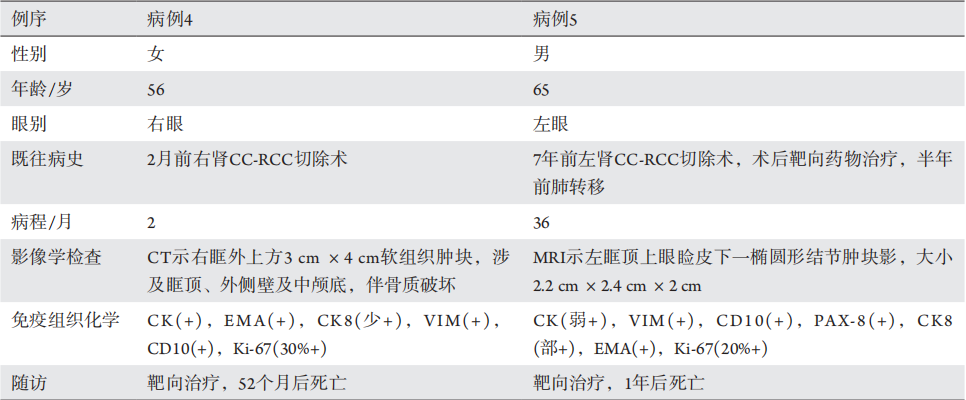
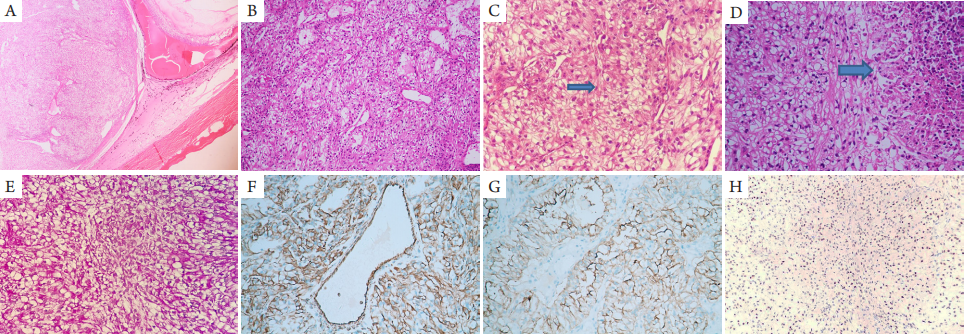
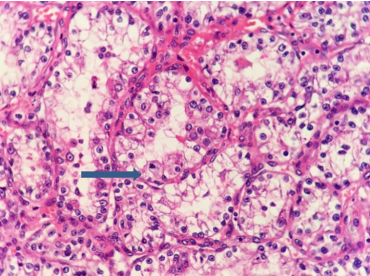
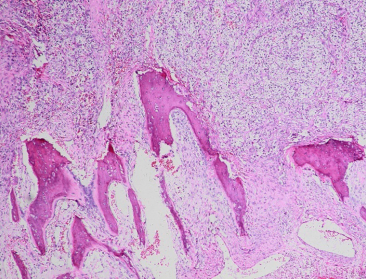
1、Flanigan RC, Campbell SC, Clark JI, et al. Metastatic renal cell
carcinoma[ J]. Curr Treat Options Oncol, 2003, 4(5): 385-390.Flanigan RC, Campbell SC, Clark JI, et al. Metastatic renal cell
carcinoma[ J]. Curr Treat Options Oncol, 2003, 4(5): 385-390.
2、Rai R , Jakobiec FA, Fay A . Ocular metastatic renal carcinoma
presenting with proptosis[ J]. Ophthalmic Plast Reconstr Surg, 2015,
31(4): e100-8.Rai R , Jakobiec FA, Fay A . Ocular metastatic renal carcinoma
presenting with proptosis[ J]. Ophthalmic Plast Reconstr Surg, 2015,
31(4): e100-8.
3、Ferry AP, Font RL. Carcinoma metastatic to the eye and orbit. I. A
clinicopathologic study of 227 cases[ J]. Arch Ophthalmol, 1974,
92(4): 276-286.Ferry AP, Font RL. Carcinoma metastatic to the eye and orbit. I. A
clinicopathologic study of 227 cases[ J]. Arch Ophthalmol, 1974,
92(4): 276-286.
4、Shields CL, Welch RJ, Malik K, et al. Uveal metastasis: clinical features
and survival outcome of 2214 tumors in 1111 patients based on primary
tumor origin[ J]. Middle East Afr J Ophthalmol, 2018, 25(2): 81-90.Shields CL, Welch RJ, Malik K, et al. Uveal metastasis: clinical features
and survival outcome of 2214 tumors in 1111 patients based on primary
tumor origin[ J]. Middle East Afr J Ophthalmol, 2018, 25(2): 81-90.
5、Shields CL, Shields JA, Gross NE, et al. Survey of 520 eyes with uveal
metastases[ J]. Ophthalmology, 1997, 104(8): 1265-1276.Shields CL, Shields JA, Gross NE, et al. Survey of 520 eyes with uveal
metastases[ J]. Ophthalmology, 1997, 104(8): 1265-1276.
6、Shields JA, Shields CL, Brotman HK, et al. Cancer metastatic to
the orbit: the 2000 Robert M. Curts Lecture[ J]. Ophthalmic Plast
Reconstr Surg, 2001, 17(5): 346-354.Shields JA, Shields CL, Brotman HK, et al. Cancer metastatic to
the orbit: the 2000 Robert M. Curts Lecture[ J]. Ophthalmic Plast
Reconstr Surg, 2001, 17(5): 346-354.
7、廖松林. 肿瘤病理诊断与鉴别诊断学[M]. 福州: 福建科学技术
出版社, 2006: 405-407.
LIAO SL. Histopathology for diagnosis and differential diagnosis
of tumor[M]. Fuzhou: Fujian Science and Technology Publishing
House, 2006: 405-407.廖松林. 肿瘤病理诊断与鉴别诊断学[M]. 福州: 福建科学技术
出版社, 2006: 405-407.
LIAO SL. Histopathology for diagnosis and differential diagnosis
of tumor[M]. Fuzhou: Fujian Science and Technology Publishing
House, 2006: 405-407.
8、Shome D, Honavar SG, Gupta P, et al. Metastasis to the eye and orbit
from renal cell carcinoma—a report of three cases and review of
literature[ J]. Surv Ophthalmol, 2007, 52(2): 213-223.Shome D, Honavar SG, Gupta P, et al. Metastasis to the eye and orbit
from renal cell carcinoma—a report of three cases and review of
literature[ J]. Surv Ophthalmol, 2007, 52(2): 213-223.
9、Alasil T, Khazai B, Loredo L, et al. Renal cell carcinoma metastasis
to the ciliary body responds to proton beam radiotherapy: a case
report[ J]. J Med Case Rep, 2011, 5: 345.Alasil T, Khazai B, Loredo L, et al. Renal cell carcinoma metastasis
to the ciliary body responds to proton beam radiotherapy: a case
report[ J]. J Med Case Rep, 2011, 5: 345.
10、Arepalli S, Kaliki S, Shields CL. Choroidal metastases: Origin, features,
and therapy[ J]. Indian J Ophthalmol, 2015, 63(2): 122-127.Arepalli S, Kaliki S, Shields CL. Choroidal metastases: Origin, features,
and therapy[ J]. Indian J Ophthalmol, 2015, 63(2): 122-127.
11、Komanski CB, Rubino SM, Meyer JC, et al. Choroidal melanoma
mimicker: a case of metastatic clear-cell renal cell carcinoma[ J]. Ocul
Oncol Pathol, 2017, 3(4): 279-282.Komanski CB, Rubino SM, Meyer JC, et al. Choroidal melanoma
mimicker: a case of metastatic clear-cell renal cell carcinoma[ J]. Ocul
Oncol Pathol, 2017, 3(4): 279-282.
12、Goldberg RA, Rootman J, Cline RA. Tumors metastatic to the orbit: a
changing picture[ J]. Surv Ophthalmol, 1990, 35(1): 1-24.Goldberg RA, Rootman J, Cline RA. Tumors metastatic to the orbit: a
changing picture[ J]. Surv Ophthalmol, 1990, 35(1): 1-24.